Alergia Alimentar na infância e suas manifestações digestivas: uma enfermidade emergente no mundo atual
Atenção! As imagens e tabelas que possam ter sido referenciadas no texto estão em processo de atualização! Em breve você acessará uma versão atualizada deste artigo.
Introdução
Alergia Alimentar (AA), aos mais diversos alimentos da dieta, constitui-se em um problema cada vez mais comum na infância, em especial durante os 2 -3 primeiros anos de vida, e pode se apresentar com um amplo espectro de sinais e sintomas que afeta principalmente os tratos digestivo, respiratório e tegumentar. O leite de vaca, durante o primeiro ano de vida, representa o principal alergeno da dieta e envolve inúmeras de suas múltiplas proteínas presentes em sua composição. É importante assinalar que alergia à proteína do leite de vaca (APLV) trata-se de uma enfermidade temporária que, na imensa maioria dos casos, apresenta remissão espontânea até o terceiro ano de vida, em alguns casos desaparece mesmo ao final do primeiro ano. Vale ressaltar que é secundada pela alergia à proteína da soja, e que, em muitas circunstâncias ocorre uma reação cruzada com APLV.
Atualmente está bem estabelecido que há um importante componente genético, que atua como fator predisponente, o qual se associa a um fator desencadeante (proteína heteróloga) para o surgimento da AA. Por outro lado, o fator genético isoladamente não pode ser responsabilizado pelo significativo aumento da prevalência das doenças alérgicas, as quais tem sido caracterizadas cada vez mais frequentemente nestas últimas 2 décadas. Este incremento deve ser definitivamente atribuído a uma série de interações do complexo “genética-meio ambiente”, as quais ocorrem durante a gravidez ou mesmo logo após o nascimento do ser humano, ainda durante os primeiros meses de vida extra-uterina (Figura 1) (1).
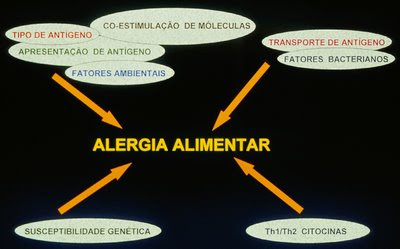
Figura 1. Esquema dos vários fatores envolvidos na gênese da AA.
Definições
Para facilitar o entendimento dos conceitos e uniformizar a nomenclatura utilizada no presente trabalho são apresentadas a seguir as definições das principais reações adversas aos alimentos.
Hipersensibilidades Alimentares são reações adversas aos alimentos que incluem quaisquer manifestações anormais resultantes da ingestão de um determinado alimento e podem ser o resultado de Intolerâncias Alimentares ou AA (2).
Intolerâncias Alimentares são respostas adversas causadas por uma característica fisiológica específica do hospedeiro, tais como as afecções metabólicas (por exemplo, deficiência de Lactase) (3).
Alergias Alimentares (AAs) são reações adversas imunologicamente determinadas que podem ser devidas a mecanismos mediados por IgE, não IgE ou mistas (4).
Reações Tóxicas podem simular Hipersensibilidades Alimentares e são tipicamente causadas por fatores inerentes aos alimentos tais como contaminantes tóxicos (por exemplo, liberação de histamina em envenenamento por determinadas espécies de peixes), ou substâncias farmacológicas contidas nos alimentos (por exemplo, tiramina em queijos envelhecidos), as quais podem afetar a maioria dos indivíduos sadios quando oferecidas em doses suficientemente elevadas (5).
Aversões Alimentares podem mimetizar reações de Intolerância Alimentar, porém, elas costumam não ser reproduzíveis quando se realiza um teste “cego” do alimento a ser ingerido e ao qual se suspeitava haver Intolerância (6).
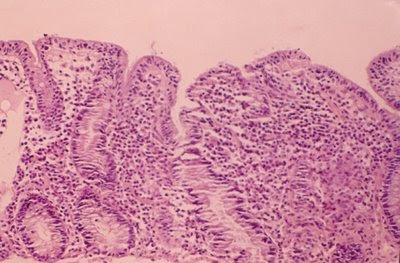
Figura 4. Material de biópsia do intestino delgado de um paciente portador de gastroenteropatia eosinofílica. Observar a atrofia vilositária associada a intenso infiltrado inflamatório linfo-plasmocitário e eosinofílico na lâmina própria da mucosa jejunal.
Resumidamente, as reações adversas (Hipersensibilidades) – Intolerâncias Alimentares ou AA – podem ser classificadas em:
1- Intolerância/Hipersensibilidade Não Alérgica
2- Alergia Alimentar/Hipersensibilidade Alérgica
• Mediada por IgE
• Não Mediada por IgE
• Mistas
3- Reações Tóxicas
4- Aversão Alimentar
Hipersensibilidade alérgica aos alimentos – AAs – necessariamente envolvem mecanismos imunológicos em reação a uma ou mais determinada proteína e podem ser divididas em 3 tipos fundamentais, a saber (7):
1- Mediadas por IgE (hipersensibilidade imediata) (Figura 2); admite-se que as reações de alergia mediadas por IgE sejam responsáveis por 60% dos casos.
2- Não mediadas por IgE (Figura 3):
a) hipersensibilidade tardia ou celular;
b) formação de imunecomplexos e vasculite.
3- Mistas, quando ambos os mecanismos estão presentes (Figura 4).
As reações mediadas por IgE tendem a surgir dentro de segundos ou minutos após a ingestão do alimento alergênico, ao passo que AA que tarda dias ou semanas para se manifestar é mais provável que não seja mediada por IgE. AA pode afetar vários sistemas do organismo e os mais frequentemente envolvidos são os tratos digestivo e respiratório, e a pele. Manifestações de APLV podem afetar todos os segmentos do trato digestivo, a saber: esôfago, estômago, intestino delgado, colo e reto (8).
Alergias Alimentares apresentam sua maior prevalência durante os primeiros anos de vida e afetam cerca de 6% das crianças menores de 3 anos de idade. Está bem estabelecido que a causa mais frequente de AA é a APLV. Aproximadamente 2,5% dos recém-nascidos demonstram reações de APLV durante o primeiro ano de vida. Muito embora a APLV seja uma enfermidade transitória, ainda assim, em torno de 80% dos pacientes afetados podem manter-se alérgicos além do primeiro ano de vida. Por outro lado, a maioria das crianças perde sua hipersensibilidade (adquire tolerância) aos vários alimentos alergênicos entre os 3 e os 5 anos de vida. Lactentes que sofrem de APLV e Soja, cuja reação imunológica não é mediada por IgE, geralmente passam a ser tolerantes a estes alimentos durante o segundo ano de vida. Aqueles lactentes que sofrem de AA (leite de vaca, soja, ovos, etc.), cuja reação imunológica é mediada porIgE tornam-se tolerantes a estes alimentos um pouco mais tarde (85% destas crianças por volta dos 5 anos de idade) (9-10-11).
Antes da década de 1950 a incidência descrita de APLV durante o primeiro ano de vida era muito baixa, aproximadamente 0,1 a 0,3%. Desde então, as estimativas da incidência da APLV aumentaram significativamente e tem variado entre 1,8 a 7,5%, dependendo dos critérios diagnósticos utilizados e da elaboração dos desenhos metodológicos das pesquisas. Indiscutivelmente, APLV é a causa de AA mais comumente confirmada entre lactentes e sua incidência no primeiro ano de vida, diagnosticada em ensaios clínicos prospectivos bem conduzidos, varia de 2 a 3%, e, em seguida vem a alergia à proteína da soja em 0,8% dos casos. É importante salientar que manifestações clínicas reproduzíveis de APLV têm sido relatadas em aproximadamente 0,5% dos lactentes em aleitamento natural exclusivo (12).
Crianças portadoras de afecções atópicas tendem a apresentar maior prevalência de AA; aproximadamente 35% das crianças portadoras de dermatite atópica moderada ou grave sofrem de AA mediada por IgE (Figura 5), e, cerca de 6% das crianças que sofrem de asma apresentam sibilância respiratória induzida por alimentos (13).
Com o objetivo de avaliar a percepção dos pais a respeito de possíveis reações adversas causadas pelo leite de vaca, Eggesbo e cols., em 2011, na Noruega, realizaram uma investigação clínica acompanhando um grupo de 3.623 crianças desde o nascimento até que completassem 2 anos de idade, através da aplicação de questionários semestrais. Os autores detectaram uma prevalência de APLV de 7,5% aos 12 meses, 5% aos 24 meses e uma incidência cumulativa de 11,6%, demonstrando, assim, a importância da percepção dos pais quanto à suspeita da existência de reações adversas ao leite de vaca e a necessidade de se estabelecer procedimentos diagnósticos apropriados (14).
Histórico
No passado, praticamente até meados do século XX, nas mais diversas formas de sociedades e culturas existentes (Figuras 6 – 7 e 8), salvo raríssimas exceções, as crianças eram rotineiramente amamentadas ao seio materno de forma exclusiva e por tempo prolongado.
Entretanto, como é do conhecimento geral, as mudanças ocasionadas pelo desenvolvimento tecnológico industrial, em meados do século XIX e definitivamente consolidadas no século XX, entre as sociedades ditas “modernas”, nas quais as mulheres passaram a ocupar um espaço significativo no mercado de trabalho, associadas ao amplo e contínuo desenvolvimento da indústria de alimentos, levaram, em consequência, a uma drástica redução da prática do aleitamento materno. Outros tipos de leite, distintos do materno, foram sendo, então, progressivamente introduzidos em idades cada vez mais precoces na alimentação dos lactentes; a partir dessa mudança de hábitos e costumes começaram a aflorar os problemas dessa nova prática nutricional e, assim, passaram a surgir as Alergias Alimentares em escala cada vez mais crescente.
Vale a pena lembrar que os efeitos adversos dos alimentos são reconhecidos desde épocas imemoriais. Hipócrates já havia observado, há 2.000 anos, que a ingestão de leite de vaca pode provocar problemas gastrointestinais e urticária, mas hipersensibilidade aos alimentos foi poucas vezes descrita até que Von Pirquet, em 1906, introduziu o conceito de Alergia. O primeiro caso de APLV foi descrito na literatura médica da Alemanha, em 1901, nos EUA a primeira referência ao problema data de 1916, enquanto que na Inglaterra verifica-se apenas uma descrição deAPLV antes de 1958 (15-16).
Na busca de substitutos do leite de vaca, para o tratamento de crianças com sintomas de alergia, passaram a ser desenvolvidas fórmulas preparadas industrialmente a partir da proteína vegetal da soja, introduzidas em 1929, ainda que tais preparações já fossem conhecidas e utilizadas desde 1909, porém em pequena escala. Posteriormente, já na década de 1940, surgiram os preparados de hidrolisados da caseína e do soro leite como alternativa no tratamento das alergias alimentares múltiplas. Mais recentemente, no fim do século XX, passaram a ser elaboradas as fórmulas à base de mistura de aminoácidos, as quais são praticamente desprovidas de quaisquer estímulos antigênicos. Elas são indicadas naqueles casos de comprovada intolerância aos hidrolisados protéicos extensivamente hidrolisados.
Genética associada ao meio ambiente: fatores que contribuem para o surgimento da Alergia Alimentar
Atualmente, está bem estabelecido que há uma significativa contribuição genética para o surgimento de alergia e, mais ainda, que inúmeros genes tem sido identificados como responsáveis pelo aparecimento tanto de eczema quanto de asma. Mutações genéticas têm sido descritas em até 27% dos pacientes portadores de eczema grave e estas parecem conferir fatores de risco para a persistência da doença, sensibilização para alergias múltiplas, e aparecimento de asma associada ao eczema. A descoberta dessas mutações genéticas demonstra de forma inequívoca a importância do papel da ruptura da barreira de defesa da pele como fator primordial na patogênese do eczema e na sensibilização alérgica (17).
É interessante assinalar que, no caso dos pacientes portadores de eczema grave, foram encontrados auto-anticorpos circulantes dirigidos contra determinadas proteínas celulares. Este fato levou à especulação de que aquilo que se iniciou como um processo essencialmente alérgico sofreu uma evolução para tornar-se uma enfermidade auto-imune. Daí a necessidade de se programar ações efetivas para prevenir a evolução da doença para a cronicidade.
A “Marcha da Alergia” nos lactentes de alto risco
Como já foi anteriormente referido APLV tende a apresentar remissão espontânea, mas geralmente vem a ser substituída por outra manifestação de alergia. O surgimento de eczema é frequentemente visto como o prenúncio de que ocorreu a sensibilização do organismo por algum alergeno alimentar, com aumento dos níveis de IgE especificamente para um determinado alimento, cujos picos séricos se mantém dentro dos primeiros 2 anos de vida. Este cortejo sintomático é seguido por um incremento da sensibilização por alergenos inalatórios, os quais, por sua vez, acarretam uma correspondente elevação na incidência de asma e rinite. Eczema atópico é geralmente a primeira manifestação da doença alérgica, sendo que cerca de metade de todos os lactentes que sofrem de eczema acabam por apresentar asma, enquanto que 2/3 deles desenvolvem rinite alérgica nos anos subsequentes. Esta associação de eventos patológicos é frequentemente referida como a “Marcha da Alergia” (18).
A sensibilização por alergenos inalatórios e alimentares é bastante comum no caso de surgimento de eczema atópico. Há uma clara evidencia de que a ocorrência de sensibilização atópica em lactentes portadores de eczema representa um marcador da intensidade da doença. A sensibilização provocada por alimentos e agentes inalatórios está associada ao aparecimento de eczemas mais graves, aumento do risco para a persistência da doença além dos 7 anos de vida, e também, risco maior para o surgimento de alergia das vias respiratórias.
Estudos realizados na década de 1980, utilizando testes de provocação, tipo duplo cego, com alimentos controlados e placebo, já comprovavam que 30 a 56% das crianças portadoras de eczema moderado ou grave apresentavam AA. A eliminação da dieta destes alergenos alimentares acarretava significativa regressão da lesão atópica. É necessário evitar a ingestão do alimento alergênico, posto que mesmo mínimas quantidades do antígeno alimentar são capazes de induzir a síntese de IgE específica, e, portanto, levar à liberação de histamina desde os basófilos, a qual por sua vez determina a deflagração dos sintomas de Alergia (19).
O acompanhamento rotineiro dos pacientes e a conseqüente realização de testes de provocação constituem importante estratégia de atuação, posto que a história natural da doença, para a vasta maioria dos pacientes, é a aquisição de tolerância em relação aos alergenos, ao longo dos tempos.
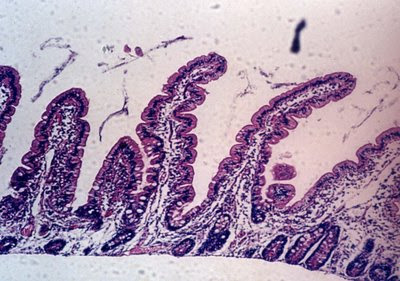
Figura 9. Material de biópsia de intestino delgado em microscopia óptica comum apresentando morfologia normal. As vilosidades são digitiformes e representam uma relação vilosidade: cripta 5/1. As células epiteliais são cilíndricas com núcleo em posição basal e o infiltrado linfo-plasmocitário encontra-se dentro dos limites da normalidade.
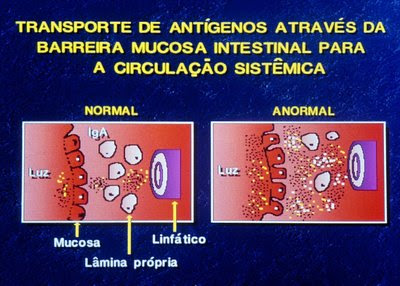
Figura 11. Exemplo gráfico do transporte de macromoléculas em situação normal e patológica, quando há fracasso de um ou mais mecanismos de constituição da barreira de permeabilidade intestinal.
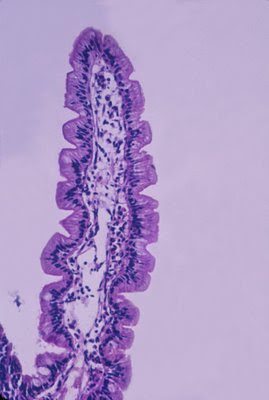
Figura 10. Vilosidade individualizada em aumento maior com aspecto digitiforme. As células epiteliais (enterócitos) são cilíndricas com núcleo em posição basal e se assentam na membrana basal. Células califormes produtoras de muco podem ser observadas ao longo das vilosidades (células esbranquiçadas arredondadas).
Conceito da Barreira de Permeabilidade Intestinal
O trato gastrointestinal representa uma extensa barreira física ao ambiente exterior com o objetivo de proteger nosso organismo das potenciais agressões físicas, químicas e microbiológicas representadas por eventuais produtos nocivos dos alimentos, dos agentes patogênicos existentes na natureza e mesmo dos simbióticos microorganismos que naturalmente nos colonizam desde a boca até o reto e com os quais obrigatoriamente de forma cotidiana convivemos. Concomitantemente, associado a esta barreira física, o sistema imunológico, por meio do tecido linfóide intestinal, funciona também como mais um fator de proteção, possuindo a capacidade de discriminar proteínas estranhas, ou microorganismos comensais, ou perigosos agentes enteropatogênicos.
Além disso, o trato gastrointestinal nos fornece também uma formidável superfície absortiva equivalente em área ao tamanho de uma quadra de tênis (aproximadamente 200m²), para que normalmente possam ocorrer os processos digestivo-absortivos, os quais são essenciais para a preservação do estado nutricional e, conseqüentemente, a manutenção da vida (Figuras 9 e 10).
A barreira de permeabilidade intestinal (Figura 11) constitui uma importante adaptação do trato digestivo ao meio ambiente extra-uterino (no interior do útero o feto se desenvolve em um meio totalmente estéril protegido pelo líquido aminiótico, o qual é envolvido pela bolsa aminiótica) contra a penetração de antígenos e fragmentos antigênicos usualmente presentes no lúmen intestinal. Ao nascer, o recém-nascido necessita estar preparado para conviver com a colonização bacteriana do intestino, com a formação de subprodutos tóxicos pelas bactérias e vírus (enterotoxinas e endotoxinas) e com a ingestão de potenciais antígenos alimentares (proteínas do leite de vaca e da soja, por exemplo). Estas substâncias que são imunologicamente ativas se conseguirem romper a barreira da mucosa intestinal e, por conseguinte, penetrar na circulação sanguínea, podem causar reações inflamatórias ou alérgicas, as quais poderão resultar, por sua vez, em enfermidades gastrointestinais ou sistêmicas.
A Tabela abaixo elenca os componentes da Barreira de Permeabilidade Intestinal contra a penetração de Antígenos
A- Não Imunológicos
Intraluminais
– Acides gástrica
– Proteólise
– Peristaltismo Intestinal
Superfície Mucosa
– Cobertura de Muco
– Membrana das Microvilosidades
– Poros intercelulares
B- Imunológico
– Sistema da IgA secretora
C- Combinação de fatores imunológicos e não Imunológicos
– Formação de imune-complexos mediados pelo muco
– Proteólise na superfície mucosa facilitada pela formação de imune-complexos
– Fagocitose pelas células de Kupffer dos imune-complexos formados

Figura 12. Ação protetora física e química da cobertura de muco sobre o epitélio intestinal.
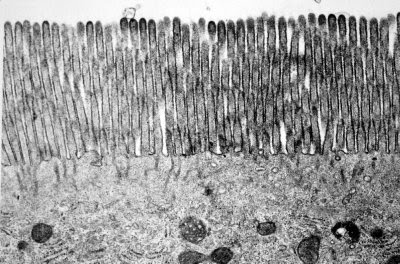
Figura 13. Material de biópsia de intestino delgado em microscopia eletrônica com estrutura preservada evidenciando a formação das microvilosidades no topo da imagem formando uma verdadeira paliçada. No interior do citoplasma podem ser observados alguns retículos endoplásmicos rugosos, mitocondrias e corpos multivesiculares.
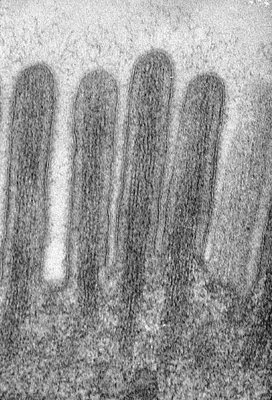
Figura 14. Material de biópsia do intestino delgado em microscopia eletrônica destacando as microvilosidades em maior aumento e as micromiofibrilas que delas emergem e que dão suporte ao muco produzido pelas células califormes.
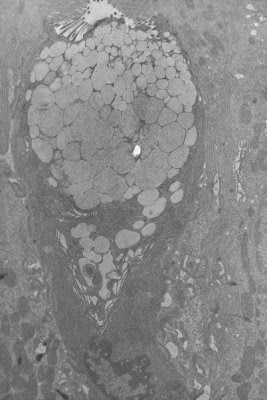
Figura 15. Material de biópsia do intestino delgado em microscopia eletrônica mostrando uma célula caliciforme produtora de muco.
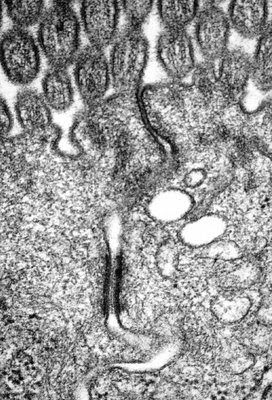
Figura 16. Material de biópsia de intestino delgado em microscopia eletrônica mostrando duas células adjacentes com poro intercelular intacto e a presença de um desmosoma em botão que confere a limitação do tamanho do poro.
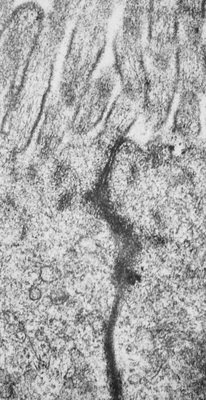
Figura 17. Material de biópsia de intestino delgado em microscopia eletrônica mostrando ruptura discreta do poro intercelular. Notar a presença, em negro, de um marcador macromolecular (Horseradish peroxidase) ao longo do espaço intercelular.
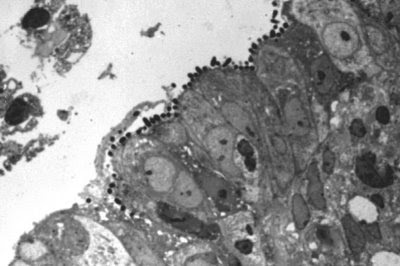
Figura 18. Material de biópsia de intestino delgado em microscopia óptica comum em grande aumento, corte semi-fino, mostrando colônias de Escherichia coli enteropatogênica firmemente aderidas à superfície mucosa provocando intensas alterações morfológicas no epitélio intestinal.

Figura 19. Esquema gráfico da sequência fisiopatológica da provocação de AA devido à infecção por Escherichia colienteropatogênica.

Figura 20. Representação esquemática da barreira da mucosa intestinal.
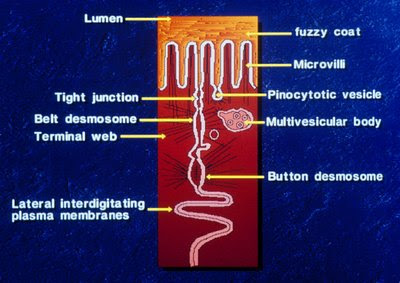
Figura 21. Representação esquemática dos mecanismos celulares de proteção da mucosa intestinal.
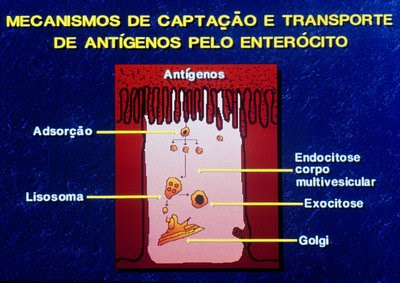
Figura 22. Representação esquemática do processo de degradação antigênica intracelular.
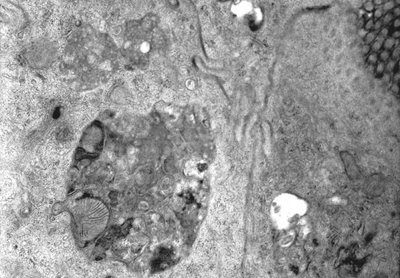
Figura 23. Material de biópsia do intestino delgado em microscopia eletrônica mostrando a formação de um corpo multivesicular, produto da ação degradativa lisosomal.

Figura 25. Material de biópsia do intestino delgado em microscopia eletrônica mostrando na figura superior duas células intestinais adjacentes submetidas à perfusão com o marcador macromolecular Horseradish peroxidase representado pela imagem enegrecida confinada à região das microvilosidades (V), L mostra o lumen intestinal. Observar o espaço intercelular (seta) totalmente preservado e a mitocôndria (M) intacta. Na figura inferior resultante da perfusão com sais biliares secundários observa-se que o marcador macromolecular provoca uma ruptura no poro intercelular e a imagem enegrecida estende-se ao longo de todo o espaço intercelular (seta). No detalhe podem ser observadas alterações importantes nas organelas com inchaço e degeneração da mitocôndria (M) e do aparelho de Golgi (G).
O ácido clorídrico produzido pelas células parietais da mucosa gástrica, entre outras finalidades, funciona como a primeira potente barreira química contra as agressões de microorganismos patogênicos que por ventura venham a ser ingeridos pelo hospedeiro. Ao mesmo tempo também atua na primeira fase da digestão dos nutrientes, em especial as proteínas, formando complexos menores que irão ser mais facilmente digeridos pelas enzimas proteolíticas pancreáticas. O peristaltismo intestinal age como fator mecânico de depuração dos potenciais agentes tóxicos e/ou microorganismos patogênicos ingeridos com a alimentação (20).
A cobertura de muco (por meio da sua espessura e composição química) que se deposita sobre a superfície das microvilosidades intestinais contribui de forma especial contra a adesão e penetração de antígenos. O muco é produzido pelas células caliciformes, as quais se encontram intercaladas aos enterócitos ao longo de todas as vilosidades intestinais (Figuras 12-13-14 e 15). A espessura física da cobertura de muco sobre a superfície da mucosa intestinal pode se expandir na dependência do estímulo antigênico recebido, contribuindo, assim, como um fator de expulsão de parasitas e antígenos microbianos intestinais (21).
Os poros intercelulares apresentam dimensões bem determinadas, e, de tal forma a permitirem a passagem apenas de água e pequenos íons, como por exemplo, sódio e cloro. Eles se constituem em um importante mecanismo fisiológico para absorção de água e eletrólitos, e, em condições normais, exceto nos primeiros meses de vida, não permitem a penetração de macromoléculas intactas (Figuras 16 e 17).
Em situações patológicas, como por exemplo, nas infecções entéricas por determinados agentes enteropatogênicos, a função seletiva destes poros intercelulares pode estar seriamente comprometida, e, portanto, passar a dar lugar para a penetração maciça de antígenos e levar ao surgimento de alergias alimentares (Figuras 18 e 19).
Além do sistema imunológico, a barreira de permeabilidade intestinal é também formada pelas próprias células epiteliais. Caso, por alguma razão, antígenos ou fragmentos de antígenos potencialmente alergênicos consigam aderir à superfície luminal dos enterócitos, estes serão interiorizados ao citoplasma por um mecanismo de endocitose (reverso da fagocitose); já agora no interior do citoplasma serão atacados e devidamente digeridos pelos lisosomas produzidos pelo aparelho de Golgi, perdendo, assim, sua capacidade de estímulo antigênico. Finalmente serão eliminados da célula no espaço baso lateral por um processo de exocitose (Figuras 21-22 e 23) (23).
Entretanto, a imaturidade no desenvolvimento de vários destes componentes da barreira intestinal e do sistema imunológico nos lactentes reduz de forma significativa sua eficiência, tornando a mucosa entérica suscetível para a penetração de antígenos potencialmente alergênicos (proteínas do leite de vaca e da soja, por exemplo) (Figuras 24 e 25). Sabe-se que a atividade enzimática no período neonatal é sub-ótima, e o sistema da IgA secretora não se encontra totalmente maduro antes dos 4 anos de idade. Conseqüentemente, o estado de imaturidade da barreira mucosa joga um papel importante na prevalência de infecções entéricas e AA observadas nos primeiros anos de vida (24).
Papel do Colostro
Como foi anteriormente mencionado, recém-nascidos e lactentes nos primeiros meses de vida são desprovidos de muitos dos fatores fisiológicos de proteção oferecidos pela barreira de permeabilidade intestinal para enfrentar o meio ambiente da vida extra-uterina. Afortunadamente, a “natureza” ofereceu um excelente substituto para proteger o lactente vulnerável durante este período crítico da existência. Este substituto, o leite humano, contém inúmeros fatores que compensam de sobra a imaturidade do organismo do lactente, e, ao mesmo tempo, estimula a maturidade do intestino para tornar-se funcionalmente independente. Tem sido largamente demonstrado que a ingestão do colostro favorece a maturação dos enterócitos, aumenta a capacidade absortiva e também acelera o desenvolvimento da barreira de permeabilidade. Além disso, o colostro tem uma ação potencializadora na produção das enzimas das microvilosidades, possui um fator de crescimento da mucosa, favorece a colonização intestinal por lactobacilos bífidos e acidófilos, oferece lactoferrina, e, mais ainda, contém uma alta concentração de IgA secretora, a qual vai proporcionar uma proteção passiva para a superfície intestinal ao longo do processo natural de maturação do intestino do lactente (25).
Alergenos Alimentares
A diversidade alimentar do ser humano nas mais variadas culturas é vastíssima, mas, na verdade apenas um número relativamente pequeno de alimentos é responsável pela ocorrência das Alergias Alimentares no nosso universo.
A sensibilização pelos alergenos alimentares pode acontecer basicamente de 2 formas, a saber:
1- Trato Gastrointestinal, considerada tradicional ou Classe 1 de AA;
2- Inalação, denominada de AA Classe 2 (26).
Os alergenos Classe 1 mais freqüentemente descritos como causadores de AA nas crianças são o leite, soja, ovo, e, nos EUA, o amendoim, enquanto que nos adultos os alergenos alimentares que mais comumente causam reações alérgicas são o amendoim, castanhas, peixes e frutos do mar.
A maioria dos alergenos alimentares Classe 1 são glicoproteínas solúveis em água com peso molecular que varia entre 10 e 70 kilodaltons, e são razoavelmente estáveis ao aquecimento, desnaturação ácida e ação das proteases.
Por outro lado, é importante ressaltar que proteínas vegetais têm sido cada vez mais caracterizadas como alergenos alimentares e cujas composições aparentemente se assemelham à dos alergenos animais. A maioria dos alergenos de origem vegetal, descritos até o presente, podem ser enquadrados em 2 grandes grupos, de acordo com suas funções na própria planta, a saber:
1- Proteínas de Defesa (incluídas as denominadas proteínas PR ou “proteínas relacionadas à patogenicidade”), as quais estão envolvidas em mecanismos de auto-proteção contra pragas, vírus e parasitas. Estas proteínas também são produzidas como respostas às agressões ambientais e conseqüentemente podem estar presentes em quantidades variáveis dentro de uma mesma espécie de fruta ou vegetal. As profilinas, que tem um papel fundamental na regulação da polimerização dos filamentos de actina e correspondem à maior porção dos alergenos Classe 2, são altamente preservadas em todo o reino vegetal e freqüentemente apresentam uma reação cruzada entre o pólen e o alimento. Os pacientes com freqüência tornam-se sensibilizados ao pólen inalado e, em virtude das reatividades cruzadas com as profilinas das frutas ou vegetais, apresentam sintomas orais e faríngeos após a ingestão da fruta crua ou do vegetal, o que é denominado deAA ao pólen ou Síndrome Alérgica Oral.
2- Proteínas de Estocagem, as quais se encontram acumuladas principalmente nas sementes maduras, e que são mobilizadas durante a germinação como fonte de Nitrogênio (amino-ácidos) e cadeias de Carbono para o embrião e a nova planta, nos momentos iniciais do desenvolvimento da mesma. Neste grupo estão incluídas as superfamílias das prolaminas e das cupinas.
A superfamília das prolaminas inclui as proteínas majoritárias das farinhas de trigo (asma do padeiro), cevada e centeio, e a albumina 2S das leguminosas, frutos secos e especiarias. A superfamília das cupinas agrupa as proteínas tipo germinas, leguminas e vicilinas. Germinas alergênicas têm sido caracterizadas na laranja, pimenta e trigo. As leguminas são alergenos proeminentes no amendoim, soja e frutos secos (castanha do Pará e avelã). As vicilinas estão presentes nos frutos secos e em sementes como o sésamo.
Manifestações Clínicas das Alergias no Trato Digestivo
As hipersensibilidades alimentares, como já anteriormente referidas, são deflagradas em indivíduos geneticamente susceptíveis, presumivelmente quando fracassa o desenvolvimento natural da tolerância oral ou quando este mecanismo sofre algum agravo importante. As reações alérgicas mediadas por IgE surgem quando anticorpos IgE alimentos-específicos residindo nos mastócitos e basófilos entram em contacto e se ligam aos alergenos alimentares circulantes e ativam as células para a liberação de potentes mediadores químicos e citoquinas. Na Tabela 2 estão discriminadas as afecções digestivas causadas por AA até o presente momento conhecidas e seus respectivos mecanismos imunológicos de ação (27).

Síndrome Alérgica Oral
Esta afecção é causada por uma grande variedade de proteínas de plantas que apresentam reação cruzada com alergenos dispersos no meio ambiente, especialmente os polens liberados pelas seguintes plantas: Ambrosia, Bétula e Artemísia. Indivíduos alérgicos a Ambrosia podem apresentar alergia a melão e banana, aqueles que são alérgicos a grama podem desenvolver sintomas ao ingerir tomate cru, e indivíduos alérgicos ao pólen da Bétula podem deflagrar sintomas depois da ingestão de alimentos crus tais como cenouras, maçãs, peras e kiwi. Tendo em vista que os alergenos responsáveis por essas reações são facilmente destruídos pelo calor e pelos ácidos gástricos, na maioria dos pacientes, as manifestações de alergia permanecem circunscritas às mucosas orais e faríngeas (28).
Anafilaxia Gastrointestinal
Esta é uma manifestação que se apresenta tipicamente de forma aguda com náuseas, dor abdominal em cólica e vômitos; pode ocorrer também o surgimento, em forma concomitante, de manifestações sintomáticas em outro órgão alvo.
Constipação
Muito embora desde longa data haja referência da associação de constipação e APLV, mais recentemente Iacono e cols. em 1995, na Itália, trouxeram este tema de volta à literatura médica. Foram avaliadas 27 crianças menores de 3 anos que sofriam de constipação crônica funcional, as quais foram submetidas a uma dieta de exclusão de leite de vaca e derivados durante 1 mês. Neste período de tempo observou-se que houve aumento no número das evacuações, que estas ocorriam sem dor, houve eliminação de fezes pastosas, e, também, ocorreu cura das fissuras anais em 78% dos casos (21/27). O teste de desencadeamento realizado nas 21 crianças resultou positivo, ou seja, as crianças voltaram a sofrer de constipação, em média 48 horas após a reintrodução do leite de vaca. Ao ser novamente retirado o leite de vaca da dieta destas crianças houve total normalização das evacuações. Posteriormente, em 1998, Iacono e cols., estudaram 65 crianças menores de 6 anos de idade que sofriam de constipação crônica funcional e que não responderam ao tratamento com laxantes. Foram realizados dois testes de desencadeamento duplo-cego e 68% (44/65) dos pacientes revelaram-se alérgicos ao leite de vaca, apresentando normalização das evacuações quando submetidos à dieta isenta de leite de vaca e derivados (29-30).
Em 2001, Daher e cols., em São Paulo, investigaram 25 crianças com idades que variaram de 3 meses a 11 anos que sofriam de constipação funcional e constataram que em 7 (28%) delas a constipação se resolveu quando o leite de vaca foi retirado da dieta por um período de 4 semanas, e, reapareceu dentro das primeiras 48-72 horas após a reintrodução do leite de vaca na dieta. Níveis elevados de IgE foram observados em 5 delas e que regrediram com a dieta de eliminação. Desta forma, alergia ao leite de vaca deve ser considerada naqueles casos de constipação refratários aos tratamentos habituais, muito embora o mecanismo fisiopatológico ainda não esteja definitivamente elucidado (31).
Gastrite Hemorrágica
Trata-se de manifestação clínica bastante incomum e até 2003 tinham sido descritos apenas 10 casos na literatura médica. Entretanto, em 2003, Machado e cols., em São Paulo, descreveram mais 2 casos de gastrite hemorrágica, em crianças de 2 anos de idade que apresentavam desde os 2 meses hematêmese, vômitos e desnutrição. Submetidos à endoscopia digestiva alta observou-se em ambos os pacientes pangastrite erosiva hemorrágica e a biópsia gástrica revelou gastrite aguda ulcerada com intenso infiltrado eosinofílico (24,1 eosinófilos/campo de grande aumento). A biópsia duodenal evidenciou atrofia vilositária sub-total e a biópsia retal colite inespecífica. Após a eliminação de leite de vaca e derivados da dieta houve total regressão da sintomatologia e recuperação do estado nutricional (32).
ESOFAGITE EOSINOFÍLICA E GASTROENTEROPATIA EOSINOFÍLICA
Estas duas entidades alérgicas podem ser mediadas por IgE e também não mediadas por IgE, ou ainda por ambos os mecanismos imunológicos. Caracterizam-se por intensa infiltração de eosinófilos ao longo das mucosas do esôfago, estômago e intestino delgado, associada à hiperplasia da zona basal, alongamento das papilas, ausência de vasculite e eosinofilia periférica em até 50% dos casos (Figura 26) (33).
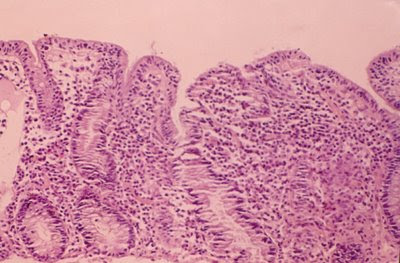
Figura 26. Material de biópsia do intestino delgado de paciente portador de Gastroenteropatia Eosinofílica, evidenciando importante atrofia vilositária e intenso infiltrado linfo-plasmocitário e eosinofílico na lâmina própria.
Esofagite Eosinofílica é mais frequentemente observada em escolares e adolescentes e tipicamente se apresenta com sintomas de refluxo gastro-esofágico, como por exemplo, náusea, disfagia, vômitos e dor epigástrica.
Gastroenterite Eosinofílica pode ocorrer em qualquer idade, inclusive em lactentes, particularmente nestes últimos a manifestação clínica pode ser de estenose hipertrófica do piloro, com vômitos intensos. Perda de peso ou ganho pondero-estatural insuficiente é uma característica marcante dessa entidade clínica. Na dependência da extensão e da localização do envolvimento do processo inflamatório, o paciente pode apresentar dor abdominal, vômitos, diarréia, sagramento intestinal, anemia ferropriva e até mesmo enteropatia perdedora de proteínas, levando a edema dos membros inferiores devido à hipoalbuminemia (Figura 27).
COLITE ALÉRGICA
A manifestação clínica mais intensa e exuberante é a diarréia sanguinolenta associada a cólicas, as quais estão presentes em cêrca de 90% dos pacientes. Geralmente os sintomas apresentam-se de início insidioso instalando-se na imensa maioria dos casos nos primeiros 6 meses de vida, mais particularmente ainda nos primeiros 3 meses. O sangue costuma ser “vivo” misturado às fezes, e, em algumas circunstâncias pode haver apenas sangramento retal em decorrência do processo inflamatório que afeta a mucosa colônica, tratando-se, portanto, de uma lesão interna. O sangramento costuma ser intermitente e de escassa quantidade; somente em raras situações pode haver perda importante de sangue, acarretando anemia aguda. Em alguns casos, especialmente quando o lactente está recebendo aleitamento natural o sangramento pode não ser visível a “olho nú”, e isto é o que se denomina sagramento “oculto”, o qual é detectado através de método imunológico em fezes recém eliminadas (34).
Regurgitação e vômitos também podem estar presentes com frequência muito variável entre 20 e 100% dos pacientes, o que pode ser um fator de interpretação equivocada da Doença do Refluxo Gastroesofágico. Na maioria das vezes não há uma clara percepção do agravo do crescimento pondero-estatural, porém, ao se instituir o tratamento correto nota-se nitidamente a ocorrência de uma rápida recuperação nutricional, com ganho pondero-estatural acelerado.
ENTEROPATIA ALÉRGICA
A Enteropatia Alérgica provocada por uma ou mais proteínas heterólogas da dieta geralmente surge nos primeiros 3 a 6 meses da vida, na imensa maioria dos casos em lactentes recebendo aleitamento artificial (não é freqüente em lactentes recebendo aleitamento natural, porém é possível a passagem de antígenos alimentares via leite humano e em conseqüência disto ocorrer manifestação de AA; vale frisar que a β-lactoglobulina, a principal proteína alergênica do leite de vaca, pode ser detectada no leite humano em 95% das mulheres durante a fase da amamentação), seja através do leite de vaca ou de outro animal, fórmulas lácteas e/ou fórmulas de soja. As principais manifestações clínicas são diarréia, caracterizada por fezes amolecidas e volumosas devido à esteatorréia, perda de peso ou ganho ponderal inadequado, parada no ritmo de crescimento em estatura, distensão abdominal com flatulência e em algumas ocasiões vômitos associados. Ao exame físico o paciente mostra-se com aspecto desnutrido, apático, tecido celular subcutâneo escasso ou mesmo praticamente ausente e hipotrofia e hipotonia muscular, em especial na região glútea (Figuras 28 e 29) (35).
O aspecto físico dos pacientes em muito se assemelha ao que se poderia alcunhar de “Doença Celíaca em miniatura”, a qual pode ser totalmente descartada, posto que, na quase totalidade dos casos, devido à precocidade da faixa etária, os lactentes ainda não tiveram a oportunidade de entrar em contacto com o trigo e derivados em suas dietas. É importante salientar que cerca de 30 a 50% dos pacientes com APLV e derivados apresentam reação alérgica cruzada à Proteína da Soja. Outro aspecto que merece ser ressaltado é que este tipo de AA é transitório tendendo a desaparecer ao final do primeiro ou segundo ano de vida, em contraste com a Doença Celíaca que é uma intolerância definitiva ao trigo e derivados. Os testes de avaliação da função digestivo-absortiva mostram-se anormais, caracterizados por má absorção da D-xilose e excreção anormalmente aumentada de gordura nas fezes, e a biópsia do intestino delgado revela uma atrofia vilositária subtotal, que pode ser focal (Figuras 30-31 e 32).
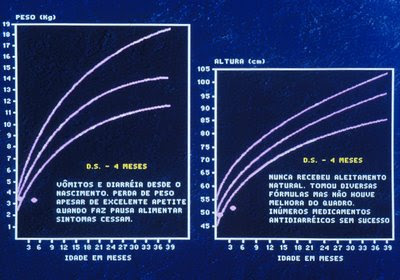
Figura 30. Gráfico de crescimento pondero-estatural da paciente por ocasião do diagnóstico; observar a perda de peso e a parada do rítmo de crescimento, uma evidencia de importante agravo do estado nutricional devido à síndrome de má absorção como consequência da Enteropatia Alérgica.
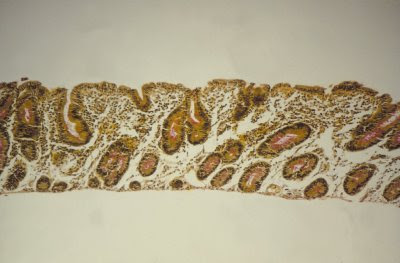
Figura 32- Material de biópsia de intestino delgado à microscopia óptica comum, aumento médio, evidenciando atrofia vilositária sub-total e discreta hipertrofia das glândulas crípticas.
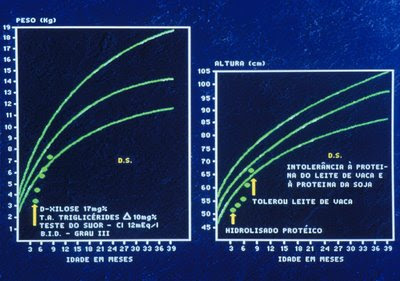
Figura 33. Gráfico pondero-estatural do paciente após tratamento dietético e recuperação clínica e nutricional.
Após a introdução de dieta apropriada os pacientes apresentam rápida reversão do quadro diarréico passando a se recuperar clínica e nutricionalmente, e, concomitantemente, o mesmo ocorre com os testes de avaliação da função digestivo-absortiva, e da morfologia do intestino delgado (Figuras 33-34 e 35).
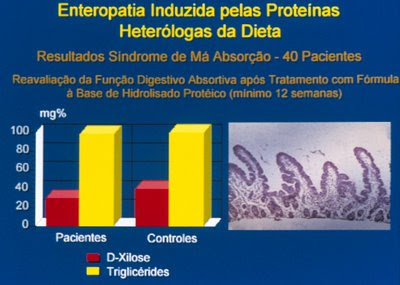
Figura 34. Comparação da avaliação da função digestivo-absortiva antes e após o tratamento em um grupo de pacientes portadores de Enteropatia Alérgica; notar também a recuperação da morfologia do intestino delgado evidenciando vilosidades digitiformes, dentro dos padrões da normalidade.
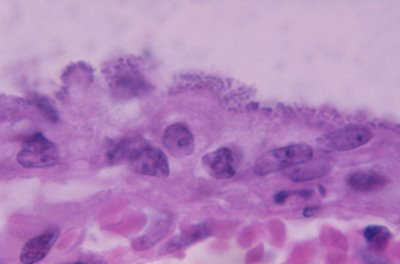
Figura 36. Material de biópsia de intestino delgado à microscopia óptica comum, grande aumento, mostrando nichos de Escherichia coli enteropatogênica firmemente aderidas à superfície mucosa do intestino delgado provocando intensa atrofia vilositária.
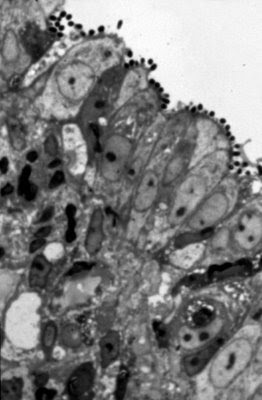
Figura 37. Material de biópsia do intestino delgado à microscopia óptica comum, corte semi-fino, evidenciando nichos de Escherichia coli aderidas à superfície epitelial do intestino delgado.
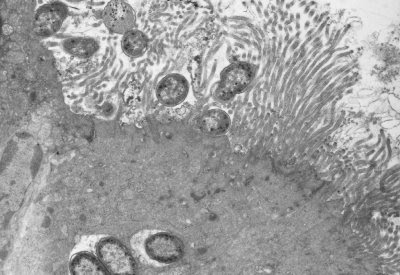
Figura 38. Material de biópsia do intestino delgado à microscopia eletrônica mostrando o início da lesão provocada por cêpa de Escherichia coli sobre as microvilosidades, levando a distorsão e alongamento das mesmas.
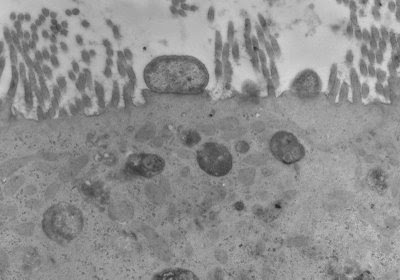
Figura 39. Material de biópsia do intestino delgado à microscopia eletrônica evidenciando a típica lesão em pedestal provocada por cêpa de Escherichia coli enteropatogênica. Notar que há total destruição das microvilosidades.
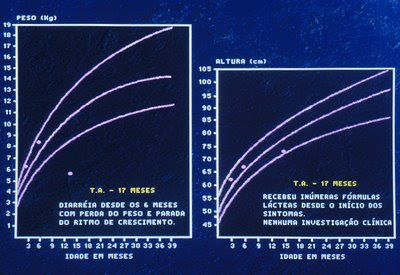
Figura 40. Gráfico do crescimento pondero-estatural da paciente portadora de AA pós gastroenterite. Notar a significativa perda de peso e completa parada do rítmo de crescimento.
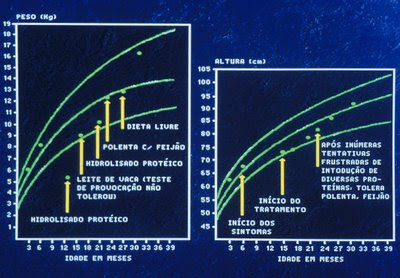
Figura 43. Gráfico de crescimento da paciente acima após a introdução de dietoterapia apropriada; notar a significativa recuperação pondero-estatural, mas ao mesmo tempo a ocorrência de AA múltipla por tempo prolongado.
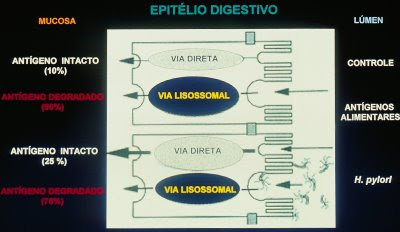
Figura 45. Esquema de lesão da mucosa gástrica provocada pelo Helicobacter pylori.
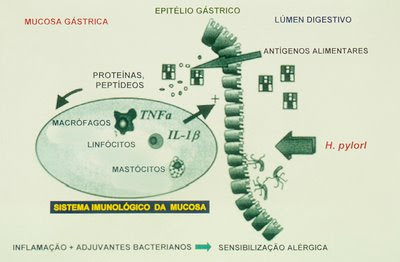
Figura 46. Esquema de proposta de provocação de AA devido a infecção pelo Helicobacter pylori.
Enteropatia Alérgica Pós- Enterite
O quadro clínico dessa síndrome em muito se assemelha à anterior, a diferença fundamental reside no fato de as manifestações clínicas surgirem em um lactente, até aquele momento sem qualquer sintomatologia suspeita de AA, após um episódio de gastroenterite aguda por algum agente enteropatogênico capaz de provocar uma lesão importante na mucosa do intestino delgado levando à ruptura da barreira de permeabilidade intestinal (Figuras 19-36-37-38 e 39), proporcionando, assim, a penetração maciça das proteínas heterólogas da dieta, potencialmente alergênicas.
Em pacientes susceptíveis de Alergia, pode-se instalar um quadro clínico de perpetuação da diarréia (diarréia persistente) associada à síndrome de má absorção com perda de peso e parada do ritmo de crescimento (Figuras 40-41 e 42).
Os principais agentes enteropagênicos potencialmente causadores deste tipo de lesão da mucosa do intestino delgado são as cepas enteropatogênicas de Escherichia coli e o Rotavirus. As Alergias Alimentares podem ser a múltiplos alimentos, e igualmente à situação acima descrita, a duração da AA é transitória, e após a introdução de tratamento dietético apropriado ocorre completa recuperação clínica e nutricional (Figuras 43 e 44).
Outro agente bacteriano patogênico para o ser humano que deve ser considerado como potencial causador de AA devido às suas propriedades de invasão da mucosa gástrica é o Helicobacter pylori (Figuras 45 e 46). Como é do conhecimento geral, a prevalência da infecção por esta bactéria é extremamente elevada em ambientes desprovidos de saneamento ambiental, com alto grau de confinamento e íntimo contacto físico interpessoal, o que pode se tornar em fator altamente propício para a deflagração de AA nos indivíduos susceptíveis.
Critérios Diagnósticos
História Clínica e Testes de Provocação
A História Clínica continua a ser o principal pilar para estabelecer o diagnóstico de AA, em especial nos pacientes menores de 6 meses de idade, posto que até esta idade a imensa maioria dos lactentes recebe apenas um tipo de alimento, seja leite de vaca ou de outro animal, fórmula láctea ou de soja. Por esta razão, torna-se mais fácil estabelecer uma relação direta causa-efeito, devido à monotonia da dieta ofertada ao lactente, diferentemente daquelas situações em que o paciente de maior idade já recebe uma dieta bastante diversificada. Vale salientar que mesmo lactentes em aleitamento natural exclusivo, embora raramente, também podem apresentar manifestações clínicas de AA devido à passagem de antígenos alimentares via leite materno. Por outro lado, naquelas crianças maiores, que já recebem uma dieta com grande diversidade de alimentos, inúmeras outras variáveis passam a entrar em jogo, o que vai dificultar sobremaneira estabelecer a qual ou a quais alimentos o paciente apresenta Alergia. A confecção de diários alimentares costuma ser útil, principalmente quando a dieta do paciente é bastante diversificada e, também, quando o problema se torna crônico.
Do ponto de vista diagnóstico é interessante tentar categorizar a afecção alérgica pelo órgão alvo predominantemente atingido e pelo mecanismo de resposta imunológica observado. Reações mediadas por IgE costumam surgir rapidamente, enquanto que as não mediadas por IgE tornam-se evidentes apenas algumas horas ou dias após a ingestão do alergeno.
Atualmente há um consenso internacional de que o Padrão Ouro (“Gold Standard”) para o diagnóstico de AA é o teste de Provocação Duplo-Cego Controlado com Placebo (PDCCP). Entretanto, há também uma aceitação geral de que na imensa maioria das vezes a realização do teste de PDCCP é praticamente inviável, em especial quanto menor for a idade do paciente. Diante da notória dificuldade de se realizar rotineiramente o teste PDCCP, tem sido também preconizada a realização de testes de provocação abertos ou simples-cegos no rastreamento de possíveis alergenos alimentares. Para aumentar a acurácia dos testes de provocação, o alimento ou os alimentos supostamente provocadores de Alergia devem ser retirados da dieta do paciente por um período de 7 a 14 dias antes da realização do teste de provocação. Vale lembrar que alguns pacientes podem sofrer de Alergia a múltiplos alimentos e, então, nestes casos é recomendável submetê-los a uma dieta à base de hidrolisado protéico extensivamente hidrolisado por um período de 4 a 6 semanas antes de serem iniciados os testes de provocação (36).
Testes Diagnósticos
Para as afecções mediadas por IgE, os testes cutâneos (“prick tests”) se constituem em um rápido e sensível método de rastreamento para alimentos específicos. Testes negativos essencialmente confirmam a ausência de reação alérgica mediada por IgE (acurácia preditiva negativa superior a 95%). Em geral, respostas negativas aos testes cutâneos são extremamente úteis para excluir Alergias Alimentares mediadas por IgE, e, por outro lado, testes cutâneos positivos, na maioria das vezes, sugerem a existência de AA, embora sua especificidade (taxa de falso positivos) não seja tão elevada quanto a sensibilidade. Idealmente, ao se obter uma resposta positiva do teste cutâneo deve-se considerar confirmatório o diagnóstico de AA quando este vier associado a uma história clínica altamente sugestiva de reação alérgica ao alimento em questão (37).
É importante assinalar que até o presente momento não se dispõe de nenhum teste cutâneo que seja confiável para o diagnóstico de AA NÃO mediada por IgE.
O teste sorológico qualitativo denominado “Radioallergosorbent test” (RAST) fornece evidências sugestivas de AA mediadas por IgE, porém este método tem a tendência de vir a ser progressivamente substituído por outros que são quantitativos, como por exemplo o CAP System FEIA, os quais tem demonstrado experimentalmente serem mais eficientes quanto aos seus valores preditivos (38).
No caso específico das manifestações das hipersensibilidades gastrointestinais uma variedade de outros testes laboratoriais podem ser extremamente úteis. Por exemplo, cerca de 50% dos pacientes portadores de Esofagite Eosinofílica e de Gastroenteropatia Eosinofílica apresentam eosinofilia periférica e podem também sofrer de anemia por perda de sangue nas fezes e diminuição nos níveis das proteínas séricas, em especial a albumina. A Endoscopia e/ou Colonoscopia com a realização das respectivas biópsias se constituem em excelentes testes diagnósticos complementares, muitas vezes evidenciando aspectos bastante característicos das lesões causadas pelos alergenos alimentares.
Os Esquemas 1 e 2, extraídos de Philippe Eigenmann e por mim modificados, ilustram uma sugestão, quanto à realização dos testes de provocação, para os passos diagnósticos das Alergias Alimentares mediadas por IgE e as não mediadas por IgE (39).
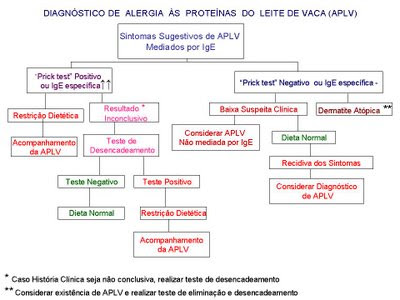
Esquema 1
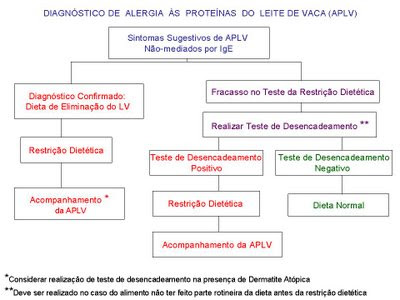
Esquema 2
Tratamento
O tratamento da AA baseia-se estritamente na eliminação do alergeno da dieta do paciente. Enquanto o paciente estiver recebendo uma dieta baseada em apenas um determinado alimento, como geralmente ocorre com os lactentes menores de 6 meses, seja fórmula láctea ou fórmula de soja, torna-se facilmente identificável qual a proteína que deve ser retirada da dieta. Entretanto, quando a dieta do paciente passa a ser mais variada já tendo ocorrido a introdução de outros alimentos a identificação do alergeno pode ser uma tarefa extremamente difícil de ser exercida com sucesso. Portanto, quanto mais diversificada for a dieta de um paciente que se suspeita ser portador de AA mais trabalhoso será identificar um ou mais agentes alergênicos. Por esta razão, estrategicamente, deve-se sempre restringir ao máximo o número e a variedade dos alimentos empregados na dieta do paciente, porém, é imperioso que se tome todo o cuidado para não provocar alguma deficiência nutricional.
Lactente em Aleitamento Artificial
Nesta circunstância o paciente deve receber única e exclusivamente uma dieta hipoalergênica, ou seja, uma fórmula à base de hidrolisado protéico extensivamente hidrolisado durante um período não inferior a 12 semanas, podendo inclusive prolongar-se até o final do primeiro ano de vida dependendo do critério do médico assistente. É esperado que as manifestações clínicas desapareçam dentro das próximas 48 horas depois da introdução da fórmula hipoalergênica. Caso os sintomas persistam ou reapareçam dentro de alguns dias após a introdução da fórmula hipoalergênica, deve-se suspeitar de intolerância à fórmula à base de hidrolisado protéico. Apesar das proteínas serem extensivamente hidrolisadas nas fórmulas à base de hidrolisados protéicos disponíveis no mercado ainda assim apresentam em sua composição pequenas frações peptídicas que podem desenvolver estímulo antigênico. Tem sido nossa experiência pessoal, aliada à experiência internacional, que cerca de 10 a 15% dos pacientes podem desenvolver intolerância às fórmulas à base de hidrolisado protéico. Ao se suspeitar ou mesmo se caracterizar a ocorrência de intolerância à fórmula à base de hidrolisado protéico, deve-se substituí-la para uma fórmula à base de mistura de amino-ácidos, a qual não tem qualquer estímulo antigênico, visto que são desprovidas de frações peptídicas potencialmente alergênicas. Após o sexto mês de vida devem ser introduzidos novos alimentos, porém, sempre tendo-se a devida precaução de evitar a utilização de leite de vaca e derivados, bem como produtos contendo soja. A introdução desses novos alimentos deve ser feita de forma gradual para que se possa ter uma observação criteriosa da sua tolerabilidade por parte do paciente. Como esta enfermidade tem caráter transitório, no final do primeiro ano de vida pode-se realizar um teste de desencadeamento com fórmula láctea. O desencadeamento deve ser realizado com supervisão médica, posto que, embora muito raramente, pode ocorrer choque anafilático caso o paciente ainda seja alérgico ao leite de vaca.
Lactente em Aleitamento Natural
Como já foi referido anteriormente o leite humano pode ser veículo de transporte de proteínas estranhas, potencialmente alergênicas, e desta forma, indiretamente, provocar manifestações de AA. Entretanto, é de fundamental importância que NÃO seja suspenso o Aleitamento Materno, e SIM tratar de eliminar da dieta da mãe o suposto alergeno. Inicialmente deve-se eliminar o leite de vaca e seus derivados, bem como a soja e todos os produtos industrializados que contenham esta substância. Além destes alimentos deve-se também propor a eliminação da dieta da mãe dos seguintes outros alimentos: amendoim, frutos secos (castanhas, nozes e avelã), frutos do mar, peixe e ovo. Após a eliminação destes alimentos a sintomatologia deve regredir significativamente, ou mesmo desaparecer dentro das próximas 48 horas. Caso a sintomatologia persista deve-se pensar que outros alimentos, além dos anteriormente referidos, também podem estar envolvidos como causa da alergia. Nem sempre é fácil detectar qual ou quais outros alimentos podem estar perpetuando as manifestações clínicas, porém, deve-se buscar à exaustação o possível alergeno por meio da elaboração de diários da alimentação da mãe, na tentativa de se estabelecer uma relação causa-efeito.
Prevenção da Alergia Alimentar
Um grupo de “experts” da seção de Pediatria da Academia Européia de Alergologia e Imunologia Clínica recentemente publicou as recomendações para prevenir as doenças alérgicas em lactentes e pré-escolares, as quais abaixo estão transcritas (40):
O aleitamento natural exclusivo é altamente recomendado para todos os lactentes independentemente da sua hereditariedade quanto à Alergia. As seguintes observações baseadas em evidências devem ser levadas em consideração:
1- A adoção de um regime dietético para a prevenção de Alergia, nos lactentes de alto risco (antecedentes hereditários de Alergia nos pais e/ou irmãos), particularmente em relação à AA (Alergia ao Leite de Vaca) e Eczema (atópico ou não atópico) mostra-se altamente eficiente. O regime dietético de maior eficácia é o aleitamento natural exclusivo por pelo menos 6 meses; porém, no caso de não ser possível a prática do aleitamento natural, a introdução de fórmula com documentada hipoalergenicidade, por pelo menos 4 meses, combinada com a restrição da introdução de alimentos sólidos e leite de vaca durante o mesmo período, é altamente recomendada.
2- Não há evidências conclusivas documentadas de que qualquer exclusão dietética na mãe durante a gravidez ou no período de lactação apresenta efeito protetor sobre o lactente.
3- Não há qualquer evidência quanto a um possível efeito preventivo no que diz respeito a imposições de restrições dietéticas após os 6 meses de vida. Além disso, há insuficiente evidência para que se faça qualquer recomendação quanto às estratégias para a dieta do desmame.
Conclusão
AA trata-se de uma entidade clínica cada vez mais prevalente afetando indivíduos de todas as faixas etárias, mas especialmente as crianças nos 2-3 primeiros anos de vida.
APLV é a enfermidade mais prevalente apresenta caráter temporário e tem remissão espontânea. AA pode envolver os mais diversos mecanismos das reações imunológicas, o que lhe confere uma sintomatologia extremamente diversificada e que pode dificultar o diagnóstico pela falta de testes suficientemente específicos para tal. O método diagnóstico para a maioria das Alergias Alimentares universalmente mais aceito é o da provocação em ensaio duplo-cego, o qual na prática, nem sempre é exeqüível. O tratamento da AA se dá pela retirada da dieta do paciente do suposto ou confirmado alergeno.
Referências Bibliográficas:
1. Cox, H., J Pediatr Gastroenterol Nutr 2008; 47:S45-8.
2. Venter, C. e cols., J Allergy Clin Immunol 2006; 117: 1118-24.
3. Johansson, S. G. e cols., J Allergy Clin Immunol 2004; 113: 832-6.
4. Du Toit, G. e cols., Pediatr Allergy Immnunol 2009; 20: 309-19.
5. Sicherer, S. H. e cols., J Allergy Clin Immunol 2004; 114: 118-24.
6. Kneepkens, C. M. F. e cols., Eur J Pediatr 2009; 168; 891-96.
7. García-Ara, C. e cols., J Allergy Clin Immunol 2001; 107: 185-90.
8. Husby, S., J Pediatr Gastroenterol Nutr 2008; 47: S49-52.
9. Kneepkens, C. M. F. e cols., Eur J Pediatr 2009; 168: 891-96.
10. Pereira, B. e cols., J Allergy Clin Immunol 2005; 11: 884-92.
11. Johansson, S.G. e cols., Allergy 2001; 56:813-24.
12. Sampson, H.A., J Allergy Clin Immunol 2004; 113:805-19.
13. Spergel, J. M. e cols., J Allergy Immunol 2003; 112: S118-27.
14. Eggesbo, M. e cols., Pediatr Allergy Immunol 1999; 10: 122-32
15. Johansson, S.G. e cols., Allergy 2001; 56: 813-24.
16. Werfel, T. e cols. Allergy 2007;62:723-28.
17. Illi, S. e cols., J Allergy Clin Immunol 2004; 113: 925-31.
18. Uguz, A. e cols., Clin Exp Allergy 2005; 35: 746-50.
19. Bindslev-Jensen, C. e cols., Allergy 2004; 59: 690-97.
20. Fagundes Neto, U., Acta Gastroent Lat Amer 1973; 5: 195-212.
21. Teichberg, S. e cols., Am J Clin Nutr 1981; 34:1281-91.
23. Teichberg, S. e cols., Pediatr Res 1983; 17: 381-389.
24. Lifshitz, F., Excerpta Medica 1984; 131-40.
25. Renz, H. e cols., Acta Paediatr Scand 1991; 80: 149-54.
26. Venter, C. e cols., Allergy 2007; 63: 354-59.
27. Sampson, H.A., J Allergy Clin Immunol 1999; 103: 981-89.
28. Sampson, H. e cols., J Allergy Clin Immunol 2004; 113: 805-19
29. Iacono, G. e cols., J Pediatr 1995; 126: 34-39.
30. Iacono, G. e cols., N Engl J Med 1998; 339: 1100-4.
31. Daher, S. e cols., Pediatr Allergy Immunol 2001; 12: 339-42.
32. Kawakami, E. e cols., Jornal de Pediatria 2003; 79: 80-1.
33. Cherian, S. e cols., Arch Dis Chil 2006; 91: 1000-4.
34. Diaz, N. J. e cols., Arq Gastroenterol 2002; 39:260-67.
35. Host, A., Pediatr Allergy Immunol 1994; 5: 5-36.
36. Bock, S. A. e cols., J Allergy Clin Immunol 1988; 82: 86-97.
37. Sampson, H. A. e cols., J Allergy Clin Immunol 1984; 74: 6-33.
38. Bousquet, J e cols., J Allergy Clin Immunol 1990; 82: 1039-43.
39. Eigenmann, P. e cols., Pediatr Allergy Immunol 2008; 19: 276-8.
40. Sampson, H. e cols., Pediatr Allergy Immunol 2008; 19: 1-4.