Doença Celíaca: um problema de saúde pública universal
Atenção! As imagens e tabelas que possam ter sido referenciadas no texto estão em processo de atualização! Em breve você acessará uma versão atualizada deste artigo.
Definição
A Doença Celíaca (DC) é uma enfermidade autoimune em decorrência de uma intolerância permanente ao glúten da dieta contido no trigo, cevada e centeio. A DC apresenta uma característica extremamente peculiar em relação às outras enfermidades autoimunes, porque para que ela ocorra é necessário que exista a contribuição de um fator ambiental claramente identificável (o glúten) associado à presença, no paciente, de um Antígeno de Histocompatibilidade (HLA – human leukocytes antigen) dominante, DQ2 ou DQ8. Classicamente ela se apresenta com diarréia crônica e parada do ritmo de crescimento pondero-estatural nos primeiros anos da vida (Figuras 1-2-3 & 4), além de vômitos e distensão abdominal.
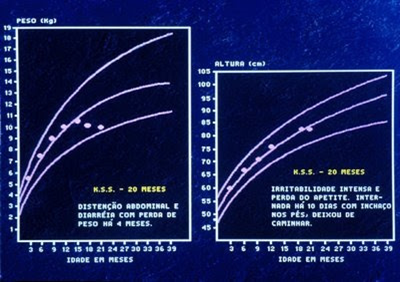
Figura 1- Gráfico de crescimento pondero-estatural da paciente portadora de Doença Celíaca por ocasião do diagnóstico.
O diagnóstico baseia-se nas alterações morfológicas da mucosa do intestino delgado, as quais embora não sejam patognomônicas, são altamente características, levando a graus variados de atrofia vilositária, infiltrado linfocitário intra-epitelial e hiperplasia das glândulas crípticas (Figura 5).
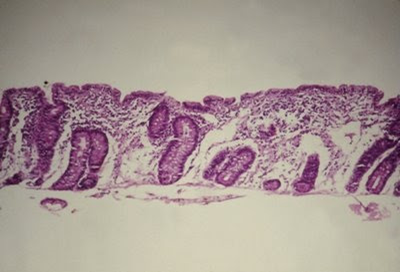
Figura 5- Material de biópsia de intestino delgado de paciente portador de Doença Celíaca evidenciando atrofia vilositária total, hiperplasia das glândulas crípticas e aumento dos linfócitos intra-epiteliais.
Vale ressaltar que os sintomas e as lesões morfológicas do intestino delgado são totalmente reversíveis com a introdução de uma dieta isenta de glúten (Figuras 6-7 & 8).
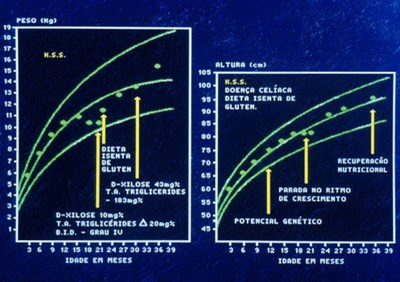
Figura 6- Gráfico de crescimento pondero-estatural da paciente após introdução da dieta isenta de glúten.
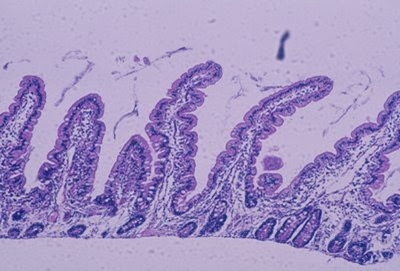
Figura 8- Material de biópsia de intestino delgado de paciente portador de Doença Celíaca 6 meses após início de dieta isenta de glúten. As vilosidades intestinais encontram-se digitiformes, as glândulas crípitcas normais e o infiltrado linfo-plasmocitário da lâmina própria discreto.
É importante enfatizar que até há alguns anos a DC era considerada rara em determinadas regiões do mundo, inclusive no Brasil, sendo potencialmente mais prevalente na Europa. Entretanto, mais recentemente, a partir da década de 1980, com a descoberta dos marcadores sorológicos, o rastreamento da DC pode ser inicialmente realizado utilizando-se estes testes, os quais apresentam elevadas taxas de sensibilidade e especificidade, tais como os anticorpos anti-endomíseo e o anticorpo anti-transglutaminase tecidual da classe IgA. Com o advento desses métodos rápidos de rastreamento sorológico ocorreu um significativo aumento no conhecimento da DC, o que possibilitou, por sua vez, também, que se estabelecesse o diagnóstico de DC em um número crescente de indivíduos, até então, aparentemente assintomáticos. Estes avanços diagnósticos possibilitaram tornar conhecidas inúmeras outras manifestações clínicas da DC, evidenciando outras variedades sintomáticas, e não mais aquelas apenas relacionadas com o trato digestivo. A DC tem sido descrita também associada com outras múltiplas enfermidades auto-imunes, como por exemplo, tireoidite autoimune e diabetes tipo I. Há também fortes evidências de uma ocorrência aumentada de DC em crianças portadoras de dermatite herpetiforme, defeitos no esmalte dentário, deficiência de IgA, síndrome de Down, síndrome de Turner e nos familiares de primeiro grau dos pacientes portadores de DC. Uma série de estudos tem demonstrado que a prevalência da DC pode estar presente também entre 5 a 13% dos irmãos dos pacientes. Tomando-se por base inúmeros estudos realizados na Europa e nos Estados Unidos, a prevalência da DC entre as crianças de dois a quinze anos na população geral é de 3 a 13 para cada 1.000 crianças, ou aproximadamente 1:300 a 1:80 crianças. No Brasil, contrariamente às previsões do passado a DC, à semelhança dos países da Europa e dos Estados Unidos, sua prevalência, embora com variação na dependência geográfica dos estudos realizados, também se configura com níveis compatíveis a um problema de saúde pública que deve ser altamente valorizado (Quadros 1 e 2).
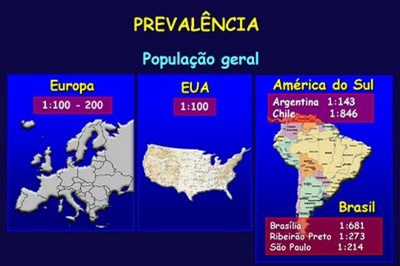
Quadro 1- Prevalência da DC em vários locais do globo terrestre.
Histórico
É fato reconhecido pelos historiadores que há cerca de 10.000 anos não havia grãos contendo glúten na natureza, e, portanto, presumivelmente, também não existia a DC. Com o advento da agricultura, o trigo e outros grãos contendo glúten passaram a ser cultivados extensivamente, o que veio a fornecer um dos dois elementos chave (o outro é a predisposição genética) para a ocorrência da DC. Entretanto, foi somente no século I da era cristã que Areteus da Capodócia relatou de forma científica a primeira descrição da DC. Ele descreveu as fezes características, o caráter crônico da enfermidade, a maior incidência na mulher e a possibilidade de crianças serem afetadas. Mais recentemente, no entanto, deveu-se a Samuel Gee, em 1888, na Inglaterra, a descrição em seu livro “On the celiac afection”, (a palavra Celíaco vem do grego e quer dizer “ventre abaulado”) muitas das características clássicas pelas quais ainda atualmente a DC se apresenta, a saber: ”indigestão crônica encontrada em pessoas de todas as idades, especialmente em crianças entre 1 e 5 anos”. Gee sugeriu ainda que a DC ocorreria por um erro dietético, e que a cura poderia ser alcançada pela introdução de uma dieta adequada. Mas, foi somente 60 anos mais tarde que o pediatra holandês Willem Karel Dicke, em 1950, acompanhando diversas crianças com deficiência pondero-estatural e esteatorréia em Haia e Utrecht, provou o efeito deletério do trigo, demonstrando que sua fração protéica, o glúten, em especial a gliadina, é o fator responsável pela instalação da DC. Porém, neste intervalo de tempo inúmeras teorias para explicar sua causa foram propostas, assim como as mais variadas tentativas terapêuticas, as quais estão disponíveis na literatura médica. Por exemplo, Schultz, em 1904, atribuía a causa da DC a uma alteração da flora putrefativa intestinal, enquanto que Herter e Holt, em 1908, propunham que a etiologia se devia à flora lactobacilar; Henfner, em 1909, considerou a existência de uma grave insuficiência digestiva após o desmame e preconizava a utilização do leite humano. Haas, em 1924, revolucionou o tratamento dietético propondo algo totalmente inédito para sua época, a dieta de banana, inclusive excluindo os carboidratos dos cereais, a qual baixou de forma espetacular a alta mortalidade da DC, e por isso tornou-se muito recomendada até 1950. Stheeman, em 1932, observou que um dos seus pacientes com DC apresentava um agravo do distúrbio diarréico em seguida à ingestão de alimentos contendo amido; a criança revelava intensa idiossincrasia a alimentos como biscoito, pão e farináceos. Ainda em 1932, Parsons fez uma revisão de 94 casos de DC ocorridos na infância e reconheceu que enquanto aleitadas exclusivamente ao seio materno as crianças não apresentavam sintomas sugestivos da enfermidade. Afirmava, também, que a DC podia afetar igualmente adultos e crianças, chamando a atenção para a grande variabilidade dos sintomas e para o papel que os carboidratos desempenhavam para o desencadeamento da enfermidade. Em 1934, Luell e Campos descreveram as alterações radiológicas presentes na DC: “motilidade intestinal diminuída, alterações no padrão da mucosa jejunal com ausência do pregueamento característico e fragmentação da coluna de bário”.
Mas, indiscutivelmente, o grande salto de qualidade na melhor compreensão dos efeitos deletérios sobre o organismo provocados pela DC se deveu ao esclarecimento da sua etiologia pelo Professor Dicke. Ele observou que na Segunda Guerra Mundial (1939-1945), durante o período da ocupação nazista na Holanda, em virtude da grande escassez de alimentos, em especial o pão (durante o racionamento não havia disponibilidade de alimentos contendo glúten, e sim outros alimentos contendo carboidratos complexos, como o amido, que embora em pequena quantidade, ainda estavam disponíveis para o consumo), paradoxalmente as crianças portadoras de DC apresentavam uma melhora clínica. Dicke observou também que, durante as internações, quando os pacientes seguiam uma dieta livre de glúten havia uma diminuição da diarreia com desaparecimento da esteatorréia e retomada da normalidade da curva de crescimento. Por outro lado, Dicke notou que após o termino da guerra estas mesmas crianças vieram a apresentar uma deterioração clínica quando os Aliados passaram a suprir alimentos à população, particularmente o pão. Subseqüentemente, Dicke publicou uma série de artigos comprovando claramente a associação do trigo e da cevada como causadores da DC.
Alessio Fasano, gastropediatra italiano radicado em Baltimore, nos EUA, tornou-se um prestigioso investigador da DC, tendo sido um dos principais responsáveis em demonstrar que a DC é tão prevalente nos EUA quanto na Europa. Fasano fez na edição de dezembro de 2008 do Journal of Pediatrics uma revisão de um relato de caso de DC publicado nesta mesma revista há 50 anos (J Pediatr 1958;53:726-30) por Graven e Tomsovic. Tratava-se de uma menina de 16 meses que foi internada devido a uma crise celíaca clássica, com palides, letargia, irritabilidade, perda de peso e distensão abdominal. Os métodos diagnósticos naquela época eram inespecíficos, incluindo a radiologia do abdome e a caracterização de esteatorréia, isto porque a ferramenta diagnóstica apropriada, ou seja, a biópsia do intestino delgado ainda não se encontrava disponível para uso rotineiro. Neste relato de caso o tratamento baseou-se em uma dieta com leite desnatado e banana. Naquela ocasião as taxas de mortalidade alcançavam até 35% e o tempo de hospitalização costumava ser muito longo, no caso presente foi de 49 dias.
Vale ressaltar que a primeira descrição da realização da biópsia do intestino delgado se deve a um médico argentino Dr. Royer, que publicou sua façanha na Prensa Médica Argentina, em 1956. No mesmo ano a médica inglesa Dra. Margot Shiner realizou a primeira biópsia de intestino delgado em um paciente com DC e publicou seu feito na revista inglesa The Lancet. Mas somente no início da década de 1960 passou-se a dispor de um equipamento apropriado para a realização rotineira de biópsias de intestino delgado, o qual foi criado por Crosby e Kugler. Vale ressaltar que Crosby era um hematologista que estava interessado em estudar a absorção intestinal de ferro. Para tal se associou ao engenheiro mecânico Kugler para desenvolver um instrumento que pudessem obter amostras de fragmentos de intestino delgado, cujo instrumento acabou sendo batizado de cápsula de Crosby-Kugler. Esta cápsula, sem dúvida alguma resultou no avanço mais espetacular para propiciar o estudo das lesões morfológicas da mucosa intestinal na DC, tornando-se, desde então até os dias atuais, o padrão ouro no diagnóstico da DC.
O primeiro caso com comprovação diagnóstica documentada com biópsia de intestino delgado, no Brasil, foi descrito e publicado em 1976, pelo nosso grupo de Gastropediatria da Escola Paulista de Medicina, constituído naquela ocasião por Ulysses Fagundes Neto e Jamal Wehba, após meu retorno da especialização realizada no Policlínico Alejandro Posadas, em Buenos Aires, em 1973 (Figuras 1-2-3-4 & 5) (Fagundes Neto, U. Ped. Prát. 47(11-12): 23-26, 1976). Depois desta primeira descrição muitos outros casos até então considerados pacientes portadores de desnutrição por verminose ou problemas de ordem sócio-econômica vieram a ser também diagnosticados. Atualmente sabe-se que a prevalência da DC no nosso meio é tão frequente quanto aquela descrita em outras regiões do mundo.
O Papel do Glúten
A DC é o resultado da interação entre o glúten e fatores imunológicos, genéticos e ambientais. A gliadina, a fração solúvel em álcool do glúten, é uma proteína rica em aminoácidos de glutamina e prolina, e que é pobremente degradada pelas enzimas digestivas. As moléculas não digeridas da gliadina atravessam a barreira de permeabilidade intestinal, provavelmente durante um processo infeccioso ou quando há um aumento da permeabilidade por qualquer outra razão, e interage com as células apresentadoras de antígeno da lâmina própria da mucosa intestinal.
Manifestações Clínicas
A DC pode afetar qualquer grupo etário e determinar uma multiplicidade de manifestações clínicas, isto é, apresenta um amplo espectro de sintomas que podem ser tanto digestivos quanto extra-digestivos, circunstância esta que provavelmente possa explicar um retardo no diagnóstico.
As formas de apresentação da DC são: 1) Clássica: neste caso predominam as manifestações digestivas e a consequente síndrome de má absorção; 2) Atípica ou Monossintomática: atualmente é a forma mais habitual de apresentação. Os sintomas digestivos são escassos ou ausentes com predomínio das manifestações extra-digestivas; 3) Silente ou Assintomática: os pacientes não costumam apresentar quaisquer sintomas, porém, apresentam sorologia positiva e atrofia vilositária na mucosa duodenal. Nesta circunstância, a DC é detectada em estudos populacionais, em familiares de pacientes portadores de DC, em indivíduos de alto risco para DC, ou ainda, naqueles pacientes que foram submetidos à endoscopia digestiva alta por motivos não relacionados à DC, mas que vieram a apresentar atrofia vilositária da mucosa duodenal (Figura 1).
A- Gastrointestinais
As manifestações clínicas da DC são extremamente variáveis e dependem muito da idade do paciente. A forma clássica de apresentação da DC nas crianças consiste no surgimento de sinais e sintomas do trato digestivo que se iniciam entre os 6 e 24 meses de vida, depois da introdução do glúten na dieta. Nos quadros típicos os lactentes e pré-escolares apresentam queixa de diarréia crônica, anorexia, distensão abdominal, dor abdominal, ganho ponderal insuficiente ou mais freqüentemente perda de peso, parada do ritmo de crescimento e vômitos (Figuras 2-3-4 & 5).
Desnutrição grave, ou até mesmo caquexia (Figura 6), podem ocorrer nos casos em que o diagnóstico é muito retardado. Alterações do comportamento, em especial irritabilidade intensa, costumam também estar presentes.
A forma Clássica de apresentação passou a ser considerada como “a parte visível do iceberg da DC”, tamanho o grau de variabilidade das manifestações clínicas desta enfermidade, que pode ser desde Monossintomática ou mesmo apenas Assintomática (silente ou latente) (Figura 7).
É importante ressaltar que nas crianças maiores, escolares e adolescentes, as manifestações clínicas costumam ser mais sutis, o que pode ser um fator de retardo no diagnóstico. Os sintomas digestivos podem incluir dor abdominal, diarréia, e até mesmo constipação, flatulência e excessiva produção de gás. Cerca de 2 a 8% dos escolares e adolescentes geralmente apresentam baixa estatura e retardo constitucional da puberdade. Ter conhecimento da curva de crescimento pondero-estatural é uma informação da mais alta valia para se poder verificar se ocorreu parada do crescimento ou mesmo diminuição da velocidade do crescimento, a qual resulta em uma mudança para baixo no percentil da curva do crescimento.
Atualmente raramente os pacientes apresentam as manifestações daquilo que se convencionou denominar de “crise celíaca”, a qual era vista com mais freqüência em passado não muito remoto. A “crise celíaca” se caracteriza por diarréia aquosa explosiva, distensão abdominal importante, hipotensão, letargia e desidratação com grave associação de distúrbios eletrolíticos, em especial hipopotassemia. Este tipo de manifestação, de instalação aguda, coloca o paciente em alto risco de vida e tem sido responsável pela causa direta de morte desta enfermidade.
B- Manifestações Extra-intestinais
Muitos pacientes recentemente diagnosticados com DC podem inicialmente se apresentar com sintomas não digestivos.
Há fortes evidências que a Dermatite Herpetiforme representa a manifestação dermatológica da DC (Figura 8), posto que a maioria destes pacientes também apresenta concomitantemente alterações morfológicas da mucosa intestinal compatíveis com a DC, mesmo na ausência de manifestações gastrointestinais. Tanto as lesões de pele quanto a morfologia da mucosa intestinal são reversíveis com a utilização de uma dieta isenta de glúten.
Defeito do Esmalte Dentário envolvendo a dentição definitiva tem sido descrito em cerca de 20% a 70% das crianças com DC, podendo mesmo ser a primeira manifestação da enfermidade (Figura 9); portanto, nestes casos, a suspeita diagnóstica de DC deve ser primariamente levantada pelo dentista.
Artrite envolvendo o esqueleto axial e periférico tem sido relatada em até 25% dos casos de DC; a artrite tem sido descrita como aguda e não erosiva que geralmente cede com a introdução de uma dieta isenta de glúten.
Osteoporose e diminuição da densidade mineral óssea têm sido relatadas em pacientes com DC não tratada, as quais se revertem com o uso de dieta isenta de glúten.
Baixa estatura pode ser uma das formas de apresentação da DC, tendo sido identificada em 8% a 10% dos pacientes.
Anemia por deficiência de ferro, refratária ao tratamento por via oral, é a causa mais freqüente de manifestação não digestiva da DC; cerca de 8% a 11% das causas inexplicadas de anemia ferropriva associadas ou não a deficiência de ácido fólico se devem a DC.
Afecções neurológicas e psiquiátricas incluindo depressão, ansiedade, irritabilidade, neuropatia periférica, ataxia cerebelar, enxaqueca e epilepsia devido a calcificações intracranianas (Figura 10) têm sido descritas em associação à DC.
Na Tabela 1, abaixo, estão discriminadas as principais manifestações extra-intestinais da DC
A) Manifestações que apresentam grande ou moderada evidência de DC
Dermatite herpetiforme
Hipoplasia do esmalte dentário (dentição definitiva)
Osteopenia/Osteoporose
Baixa estatura
Puberdade ratardada
Anemia ferropriva refratária a tratamento oral com ferro
B) Manifestações que apresentam evidência menos intensa
Hepatite
Artrite
Epilepsia com calcificações occipitais
Na Tabela 2, abaixo, estão discriminadas associações que apresentam prevalência aumentada com DC
Diabete tipo 1
Tireoidite autoimune
Síndrome de Down
Síndrome de Turner
Síndrome de Williams
Deficiência seletiva de IgA
Parentesco de primeiro grau
Os Marcadores Sorológicos: os testes laboratoriais que permitiram desvendar a parte não visível do “iceberg” da Doença Celíaca
Embora a biópsia do intestino delgado ainda seja considerada absolutamente necessária para a confirmação diagnóstica da DC, a introdução dos testes sorológicos, a partir da década de 1980, trouxe uma enorme contribuição para identificar quais indivíduos devem ser submetidos a este procedimento diagnóstico. Além disso, esses testes passaram também a ser utilizados para rastreamentos populacionais o que possibilitou desvendar o que se convencionou designar como a porção submersa do “iceberg” da DC, a partir da investigação pioneira conduzida por Catassi e cols., em 1996. Estes pesquisadores realizaram um estudo multicêntrico na Itália utilizando inicialmente os marcadores sorológicos em uma população de estudantes. Naqueles indivíduos que apresentavam positividade para os marcadores sorológicos realizou-se a biópsia do intestino delgado, o que possibilitou caracterizar que a prevalência da DC é de 1 para cada 184 indivíduos. A partir deste estudo inúmeras outras investigações epidemiológicas populacionais passaram a ser realizadas nos mais diversos países, inclusive no Brasil, as quais demonstraram cabalmente que a DC está longe de ser uma enfermidade rara, e sim, muito ao contrário, trata-se de um problema de saúde pública universal (Tabela 1).
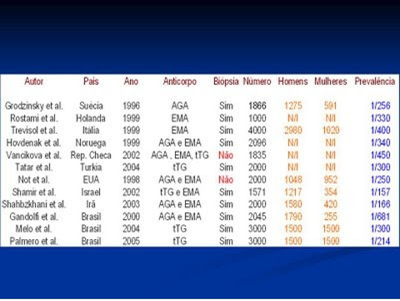
Tabela 1- Prevalência da DC em diversos países, inclusive no Brasil.
Os testes laboratoriais comercialmente disponíveis incluem os anticorpos anti-gliadina IgA e IgG (AGA IgA e AGA IgG), anti-reticulina IgA (ARA), anti-endomíseo IgA (EMA) e anti-transglutaminase tecidual IgA e IgG (ATTG).
A sensibilidade e a especificidade destes testes sorológicos estão discriminadas na Tabela 2.
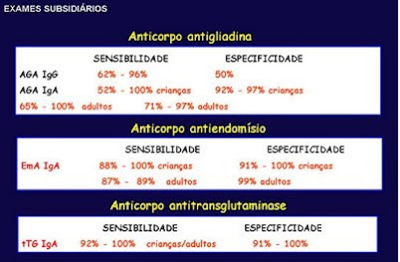
Tabela 2- Sensibilidade e Especificidade dos principais marcadores sorológicos para DC.
Dentre os vários marcadores sorológicos disponíveis atualmente, os mais utilizados são o EMA e o ATTG, porque apresentam as mais altas taxas de sensibilidade e especificidade.
Estudos populacionais com doadores de sangue têm-se constituído em uma casuística muito freqüentemente utilizada pelos pesquisadores em virtude da facilidade de se utilizar o sangue estocado. Ricardo Palmero Oliveira, pesquisador da Disciplina de Gastropediatria da Escola Paulista de Medicina da UNIFESP e colaboradores (European Journal of Gastroenterology and Hepatology 19: 43-9, 2007), realizaram um estudo com 3.000 candidatos a doadores de sangue para determinar a prevalência da DC em São Paulo com o emprego do ATTG e confirmação diagnóstica pela biópsia do intestino delgado. O teste sorológico resultou negativo em 95,4% (2861/3000), mostrou-se fracamente positivo em 3,1% (94/3000) e positivo em 1,5% (45/3000) dos indivíduos. Dentre os 94 candidatos a doadores de sangue que apresentaram dosagem do ATTG fracamente positivo 91 eram assintomáticos, 1 apresentava queixa de constipação e dor abdominal e 2 queixavam-se de dor abdominal. Dentre os 45 candidatos a doadores de sangue que apresentaram dosagem do ATTG positivo 46,7% (21/45) concordaram em realizar a biópsia do intestino delgado. Na Tabela 3 estão discriminados os aspectos clínicos e laboratoriais relevantes dos indivíduos que realizaram a biópsia do intestino delgado.
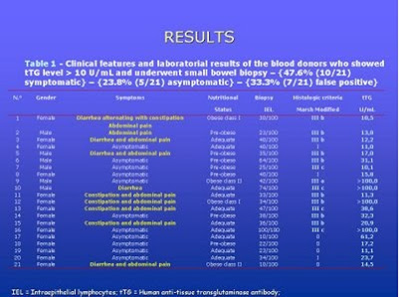
Tabela 3- Aspectos clínicos e laboratoriais relevantes dos indivíduos que realizaram a biópsia do intestino delgado.
Na Tabela 4 estão discriminados os aspectos clínicos e laboratoriais relevantes dos indivíduos que não realizaram a biópsia do intestino delgado.
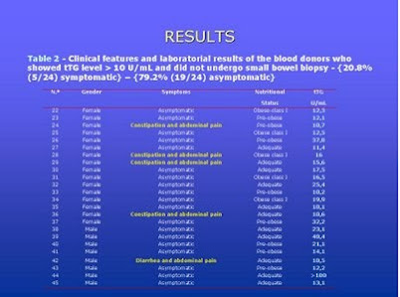
Tabela 4- Aspectos clínicos e laboratoriais relevantes dos indivíduos que não realizaram a biópsia do intestino delgado.
Na Tabela 5 estão discriminadas as manifestações clínicas que podem estar associadas à DC, mostrando que indivíduos da população geral que apresentam sintomas compatíveis com DC têm maior probabilidade de serem portadores da enfermidade.
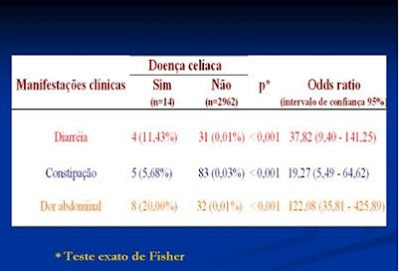
Tabela 5- Manifestações clínicas associadas à DC.
Dentre os indivíduos que se submeteram à biópsia do intestino delgado confirmou-se o diagnóstico de DC em 66,7% (14/21) deles, ou seja, a prevalência da DC nesta população revelou ser de 1:214 indivíduos. Por outro lado, caso todos os indivíduos que apresentaram dosagem elevada do ATTG e que se recusaram a realizar a biópsia do intestino delgado (24/45), tivessem também se submetido ao referido procedimento, e considerando-se que o ATTG revelou-se falso positivo em 33,3% dos indivíduos que se submeteram à biópsia do intestino delgado e que confirmaram ser portadores da DC, a prevalência seria maior, porque se poderia especular que 66,7% (16/24) dos indivíduos que não realizaram a biópsia de intestino delgado seriam também portadores de DC. Neste caso, ao acrescentarmos mais 16 indivíduos aos 14 com diagnóstico de DC confirmado, totalizaríamos 30 dos 3000 candidatos a doadores de sangue no grupo com DC. Desta forma, então, a prevalência da DC em São Paulo passaria a ser de 1:100 indivíduos, portanto, tão elevada quanto à verificada em outros países, em especial na comunidade européia (Tabela 6).
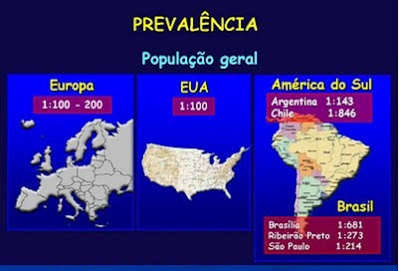
Tabela 6- Distribuição da prevalência da DC no mundo ocidental.
O papel desempenhado pela Genética na Doença Celíaca
A suscetibilidade para a ocorrência da DC está, em parte, determinada por uma associação com um Antígeno de Histocompatibilidade (HLA – human leukocytes antigen) dominante comum: especificamente, com o mais importante complexo de antígenos classe II de histocompatibilidade, DQ2 e DQ8. Esses genes são codificados para glicoproteinas que se ligam a peptídeos e formam um complexo antigênico HLA que pode ser reconhecido pelas células T receptoras CD4+ na mucosa intestinal. O gene DQ2 está presente em cerca de 90% dos pacientes e quando esses alelos são homozigotos respondem pela instalação precoce da forma clássica da DC. Vale ressaltar que embora o gene DQ2 represente a base da suscetibilidade genética da DC, eles estão presentes em cerca de 30% de toda a população. O gene DQ8 está presente na maioria dos restantes 10% dos pacientes. Portanto, como as moléculas de DQ2 e DQ8 respondem pela quase totalidade dos pacientes com DC, a ausência das mesmas, nos testes genéticos, praticamente exclui a possibilidade da existência da DC em um determinado indivíduo. Vale ressaltar, porém, que embora DQ2 esteja presente em 30% da população geral e que tanto DQ2 como DQ8 estejam presentes em 40% da população geral, a auto-imunidade para DC irá surgir em apenas cerca de 3% da população geral que possui DQ2. Desta forma as sondas genéticas para DQ2 e DQ8 apresentam alta sensibilidade (baixas taxas de falso negativo), mas baixa especificidade (altas taxas de falso positivo), indicando, portanto, baixo valor preditivo positivo, mas um alto valor preditivo negativo para a DC.
Diagnóstico
O diagnóstico da DC usualmente é suspeitado em um primeiro momento pela presença dos auto-anticorpos, porém, deve sempre ser confirmado pela realização da biópsia de intestino delgado. Há uma série de artigos disponíveis na literatura médica demonstrando que o diagnóstico baseado em critérios clínicos levando-se em consideração apenas as manifestações gastrointestinais mostraram-se incorretos em mais de 50% dos casos. Exames radiológicos ou mesmo outros testes laboratoriais também são incapazes de definir corretamente a existência ou não da atrofia vilositária. Entretanto, a visão macroscópica obtida quando da realização da endoscopia digestiva poderá em certos casos antecipar a existência de atrofia vilositária sub-total (Figuras 1 & 2).
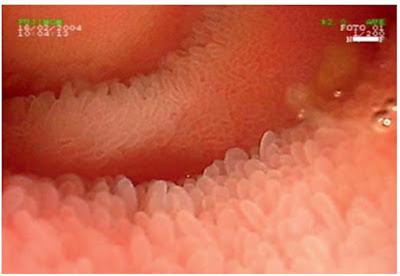
Figura 1- Visão macroscópica da mucosa duodenal evidenciando nitidamente as vilosidades integras.
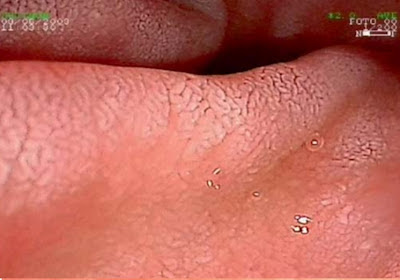
Figura 2- Visão macroscópica da mucosa duodenal evidenciando atrofia vilositária com aspecto cerebriforme.
Atualmente, é consenso internacional que crianças maiores de 2 anos de idade (em crianças menores as mesmas alterações histológicas também podem ser observadas em lactentes portadores de enteropatia por alergia à proteína do leite de vaca), que apresentam manifestações clínicas sugestivas da DC associadas a lesões morfológicas características do intestino delgado, e que evoluem para a recuperação clínica e nutricional quando submetidas à dieta isenta de glúten, o diagnóstico da DC pode ser considerado definitivamente correto, sem que haja necessidade da realização de novas biópsias do intestino delgado. Além disso, caso tenham sido demonstrados auto-anticorpos antes do diagnóstico e o conseqüente desaparecimento dos mesmos, após a introdução da dieta isenta de glúten, estes eventos reforçam ainda mais o acerto diagnóstico da DC.
As características lesões morfológicas da mucosa do intestino delgado descritas na DC incluem um número aumentado de linfócitos intra-epiteliais (>30 linfócitos por 100 enterócitos), índice mitótico dos linfócitos intra-epiteliais superior a 0,2%, diminuição na altura das células epiteliais, com transformação cuboidal, hiperplasia das criptas, atrofia vilositária parcial ou total, com nítida diminuição da relação vilosidade:cripta (Figuras 3 & 4).
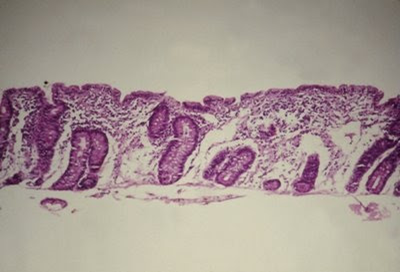
Figura 3- Aspecto histopatológico característico da Doença Celíaca. Atrofia vilositária total, transformação cuboidal do epitélio, com hiperplasia das criptas e infiltrado intra-epitelial de linfócitos.
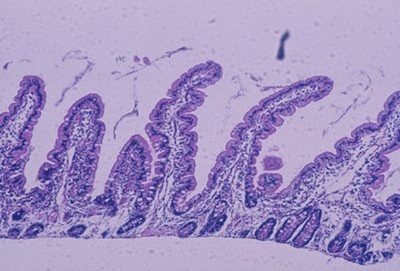
Figura 4- Aspecto da histologia normal da mucosa do intestino delgado, apresentando vilosidades digitformes, células epiteliais cilíndricas com núcleo em posição basal e glândulas crípticas preservando a relação vilosidade/cripta 4ou5:1.
Presentemente, os critérios diagnósticos de graduação das alterações morfológicas da mucosa intestinal aceitos internacionalmente para o diagnóstico da DC são os propostos por Marsh, em 1992 (Figuras 5 & 6) (Gastroenterology 102: 330-54).
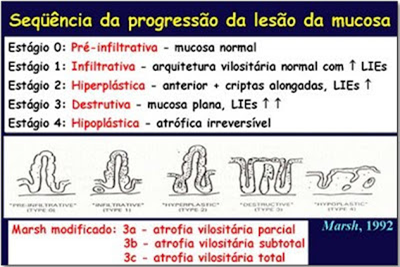
Figura 5- Representação esquemática dos critérios de Marsh para o diagnóstico da Doença Celíaca.
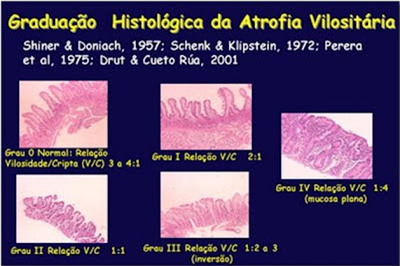
Figura 6- Graduação histológica das lesões do intestino delgado na Doença Celíaca.
Marsh classificou as alterações histológicas para o diagnóstico da DC nos seguintes graus, a saber: Grau 0, estágio pré-infiltrativo (normal), Grau 1, lesão infiltrativa (aumento do número de linfócitos intra-epiteliais), Grau 2, lesão hiperplásica (Grau 1 + hiperplasia das criptas), Grau 3, lesão destrutiva (Grau 2 + atrofia vilositária parcial), Grau 4, lesão hipoplásica (atrofia vilositária total com hipoplasia críptica). A lesão Grau 3 foi modificada para ser subdividida em Grau 3a (atrofia vilositária parcial), Grau 3b (atrofia vilositária subtotal) e Grau 3c (atrofia vilositária total).
A existência de lesão Marsh Grau 3 com atrofia vilositária, ou mais intensa, é aceita como claro aspecto diagnóstico da DC. A ocorrência de lesão Marsh Grau 2 associada à positividade de marcadores sorológicos é altamente sugestiva da DC. A existência da lesão histológica Marsh Grau 1 é considerada inespecífica, porém, se essa lesão vier acompanhada de positividade dos marcadores sorológicos deve-se considerar fortemente o diagnóstico de DC. Nesta situação deve-se realizar a tipagem HLA e se necessário repetir a biópsia do intestino delgado, ou então, indicar o emprego da dieta isenta de glúten e após 6 meses repetir os testes sorológicos e a biópsia do intestino delgado.
Uma proposta de diagnóstico precoce da Doença Celíaca: uma nova revolução desvendando ainda mais a parte não visível desta enfermidade
É consenso internacional que o critério diagnóstico de certeza da DC é a demonstração de atrofia vilositária Marsh 3. Entretanto, há evidencias de que a lesão da mucosa do intestino delgado se instala de forma gradual, e, portanto, admite-se que enteropatias moderadas podem evoluir para atrofia vilositária total e hiperplasia das criptas, caso a ingestão de glúten se mantenha de forma continuada. Dados atuais sugerem que alguns pacientes que apresentam somente enteropatias moderadas podem apresentar sintomas ou mesmo complicações clínicas em decorrência da ingestão de glúten antes de desenvolverem atrofia vilositária total. Este fato desperta a inevitável questão se acaso os atuais critérios diagnósticos para caracterizar a DC ainda sejam válidos (Figura 1).
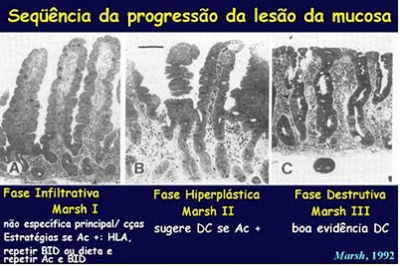
Figura 1- Aspectos progressivos da lesão do intestino delgado na Doença Celíaca.
Kalle Kurppa e colaboradores (Gastroenterology 2009; 136: 816-23), em Tampere, na Finlândia, levando em consideração a hipótese acima considerada realizaram uma investigação clínica controlada, de forma prospectiva e randomizada, para avaliar o efeito da intervenção do glúten em pacientes suspeitos de sofrerem de DC que apresentavam positividade ao autoanticorpo anti-Endomíseo (EMA) e que à biópsia do intestino delgado evidenciavam linfocitose, mas arquitetura vilositária normal. Foram realizadas biópsias de intestino delgado em 70 pacientes EMA positivos, e destes, 23 apresentavam apenas enteropatia moderada (Marsh 1-2), os quais foram aleatoriamente distribuídos para continuarem recebendo dieta contendo glúten ou dieta isenta de glúten. Após o período de 1 ano foram repetidas as avaliações clínicas, sorológicas e histológicas. Um grupo de 47 pacientes com lesões da mucosa do intestino delgado compatíveis com DC (Marsh 3) e submetidos à dieta isenta de glúten serviram como grupo controle enfermo.
No grupo que recebeu dieta contendo glúten (Marsh 1-2) a arquitetura da mucosa intestinal se agravou em todos os indivíduos, e os sintomas persistiram assim como a positividade do EMA. Em contraste, naquele grupo que recebeu dieta isenta de glúten os sintomas desapareceram, os títulos do EMA diminuíram, e a morfologia da mucosa intestinal se normalizou, da mesma forma que ocorreu no grupo controle enfermo. Quando o ensaio clínico terminou todos os indivíduos decidiram adotar uma dieta isenta de glúten.
Os autores concluiram que os indivíduos que apresentaram EMA positivo se beneficiaram com a adoção de uma dieta isenta de glúten, a despeito de não apresentarem atrofia vilositária total. Baseados nos resultados dessa pesquisa os autores propõem que os critérios diagnósticos para DC necessitam ser revistos, valorizando os resultados positivos dos marcadores sorológicos EMA e ATTG, até então considerados “falso positivos”. Enfatizam que a positividade dos marcadores sorológicos mesmo na ausência de atrofia vilositária é uma indicação para a adoção de uma dieta isenta de glúten.
Levando-se em consideração os resultados dessa importante pesquisa, e, nos colocando na expectativa de que essas observações sejam confirmadas em outros centros, passaremos a admitir que a parte não visível do “iceberg” é ainda maior do que aquela até o presente momento conhecida.
Tratamento
Atualmente, o único tratamento disponível para a DC é dietético, consistindo na eliminação do trigo, centeio e cevada, de forma permanente, da dieta do paciente.
É fortemente recomendável que o tratamento com a dieta isenta de glúten apenas se inicie após a confirmação diagnóstica por meio da realização da biópsia do intestino delgado.
É de fundamental importância o cumprimento efetivo da dieta isenta de glúten a fim de assegurar desenvolvimento pôndero-estatural e puberal adequados, manter adequada a densidade mineral óssea, preservar a fertilidade, reduzir o risco de anemia ferropriva e de deficiências de outros micro-nutrientes, bem como prevenir o surgimento de doenças malignas do trato digestivo, tal como o linfoma do intestino delgado. Entretanto, é do conhecimento geral que, na prática, manter a obediência restrita à dieta isenta de glúten de forma permanente é um grande desafio para o médico e para o paciente. A transgressão alimentar pode ser voluntária ou inadvertida. A transgressão voluntária costuma ocorrer em todas as faixas etárias e a inadvertida ocorre devido a incorreta inscrição dos ingredientes nos rótulos dos alimentos, ou então, à contaminação com glúten em um determinado produto industrializado.
Vale a pena frisar que há poucos estudos disponíveis na literatura médica a respeito das taxas de adesão à dieta isenta de glúten. Vera Lúcia Sdepanian, juntamente com Ulysses Fagundes Neto e colaboradores (Arquivos de Gastroenterologia 2001; 38: 232-38) Professores da Disciplina de Gastroenterologia Pediátrica da Escola Paulista de Medicina da UNIFESP realizaram uma investigação com o objetivo de avaliar a obediência à dieta isenta de glúten, o conhecimento teórico acerca da DC e seu tratamento pelos pacientes cadastrados na Associação dos Celíacos do Brasil (ACELBRA). Foi enviado pelo correio um questionário para se determinar a obediência da adesão à dieta isenta de glúten, do conhecimento teórico e do tratamento da DC a 584 membros cadastrados na ACELBRA. Foram retornados 529 (90,6%) questionários devidamente preenchidos, os quais revelaram que 69,4% dos pacientes nunca ingerem glúten e 29,5% reconhecem que não cumprem a dieta de forma restrita. A proporção dos pacientes que ingere glúten freqüentemente ou que não faz restrição alguma é maior entre aqueles com idade igual ou maior a 21 anos (17,7%) do que os com idade menor (9,9%). A freqüência de obediência à dieta isenta de glúten foi maior quando o intervalo de tempo em que foi estabelecido o diagnóstico da DC foi inferior a cinco anos. Para 96,2% dos pacientes que responderam ao questionário a dieta deve ser totalmente isenta de glúten, enquanto que para os 3,8% restantes o glúten pode ser ingerido semanal ou mensalmente. Segundo 67,1% dos pacientes o glúten é uma proteína, enquanto que para 10,2% é uma enzima, 5,5% um carboidrato, 0,6% uma gordura e 16,6% responderam que não sabiam. Quanto aos cereais onde o glúten está presente 98,7% responderam no trigo, 94,7% na cevada, 95,1% na aveia, 93,4% no centeio e 1,0% no arroz. Com relação aos possíveis substitutos dos alimentos que contém glúten, a farinha de milho foi referida em 97,9% dos inquéritos, o polvilho em 98,3%, a fécula de mandioca em 98,9%, e a farinha de arroz em 97,5%. Este estudo demonstra que o esclarecimento da causa da DC e seu respectivo tratamento exercem papel fundamental no cumprimento da dieta isenta de glúten de forma restrita.
Monitoramento dos Pacientes
Recomenda-se que os pacientes portadores de DC sejam monitorados por meio de visitas periódicas ao médico, para que este possa avaliar a existência ou não de sintomas compatíveis com transgressões dietéticas, analisar a curva de crescimento e a adesão à dieta isenta de glúten.
Recomenda-se também a determinação dos auto-anticorpos (ATTG ou EMA) após os primeiros 6 meses da confirmação diagnóstica pela biópsia do intestino delgado e do início do tratamento com dieta isenta de glúten. Caso a dieta esteja sendo rigorosamente cumprida o título do auto-anticorpo deve cair abruptamente ou mesmo desaparecer. Por outro lado, caso o título permaneça elevado associado ou não a alguma manifestação clínica é muito provável que o paciente esteja transgredindo a dieta isenta de glúten voluntária ou inadvertidamente.