Diarréia Persistente: uma guerra cujo campo de batalha é o lúmen intestinal
Atenção! As imagens e tabelas que possam ter sido referenciadas no texto estão em processo de atualização! Em breve você acessará uma versão atualizada deste artigo.
Introdução
A doença diarréica, a despeito dos consideráveis avanços ocorridos nos conhecimentos dos mais diversos mecanismos fisiopatológicos de ação dos inúmeros agentes enteropatogênicos responsáveis pela infecção entérica e do seu manejo na prática clínica, ainda é responsável por uma significativa proporção de mortes em crianças menores de 5 anos de idade em todo o globo terrestre, em especial, nos denominados países em desenvolvimento (Figuras 1 & 2).
Felizmente as taxas de mortalidade vêm decaindo ao longo dos tempos, desde o início dos anos 1980, quando a diarréia provocava a morte de 4,5 milhões de crianças anualmente para em 2003 ter sido responsável pela morte de 1,6 a 2,3 milhões de crianças abaixo dos 5 anos de idade nos países em desenvolvimento. Em 2008 ocorreram 1,8 milhões de mortes por diarréia o que representa 19% das 10 milhões de mortes ocorridas em crianças menores de 5 anos de idade. Ficou comprovado que 15 países da África e da Ásia foram responsáveis por 78% dessas mortes (Figuras 3 & 4).
Desnutrição e diarréia são as mais flagrantes conseqüências de uma verdadeira guerra cujo teatro das ações se dá no interior do intestino. Esta guerra apresenta características altamente dramáticas porque o campo de batalha é totalmente não convencional (o lúmen intestinal) e o inimigo invasor que é invisível (microorganismos enteropatogênicos) coloca à prova toda a capacidade de defesa do hospedeiro sem que haja qualquer previsão de quando o processo irá ocorrer. Portanto, o organismo necessita estar constantemente de prontidão, sempre preparado com todas suas defesas perfeitamente alinhadas, para tentar se proteger de um potencial ataque que pode se dar de forma completamente inesperada. Quando o microorganismo invasor vence a batalha, uma vasta gama de problemas pode ser criada para o hospedeiro, posto que as infecções sintomáticas podem alterar as funções digestivo-absortivas, provocar ruptura da barreira de permeabilidade intestinal, e mesmo à depleção hídrica e salina do paciente causando desidratação e desequilíbrio eletrolítico, choque hipovolêmico e alto risco de morte (Figuras 5 – 6 & 7).
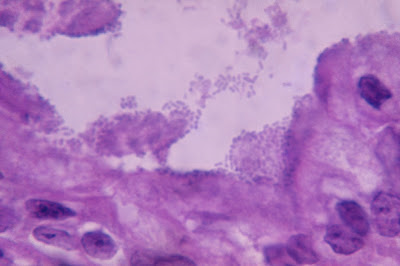
Figura 5- Microfotografia em microscopia óptica comum de uma biópsia de de intestino delgado de um paciente portador de infecção por Escherichia colienteropatogênica O111 evidenciando a presença de nichos bacterianos firmemente aderidos à superifície epitelial dos enterócitos.
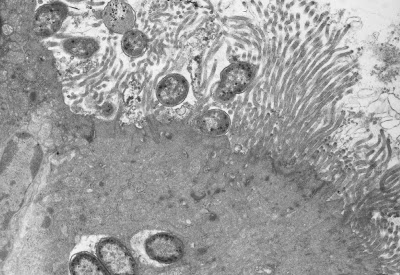
Figura 6- Ultramicrofotografia de uma biópsia de intestino delgado de um paciente portador de infecção por Escherichia coli O111 na sua fase incial de produção da clássica lesão denominada “attachment and effacement”.
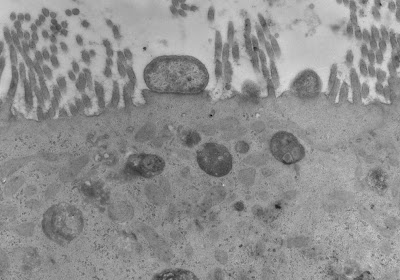
Figura 7- Ultramicrofotografia de uma biópsia de intestino delgado de um paciente portador de infecção por Escherichia coli enteropatogênica O111, evidenciando a presença da bactéria formando um pedestal sobre o enterócito com as microvilosidades totalmente destruídas.
Portanto, o diagnóstico correto e a intervenção terapêutica eficaz se revelam de crucial importância, não somente para o indivíduo enfermo, mas também para propor medidas de prevenção para proteção de toda a comunidade aonde ele vive, para evitar que o agente enteropatogênico se dissemine de forma incontrolável. A maioria das infecções entéricas são contraídas através da água e/ou dos alimentos contaminados, e estas infecções podem ser transmitidas por contato direto pessoa-pessoa, principalmente em condições de grandes conglomerados humanos ou em comunidades desprovidas de fornecimento de água potável e saneamento básico que apresentam altas taxas de contaminação ambiental, tal como ocorre em nossas favelas.
Durante a década de 1980 estimava-se que de 3 a 20% dos episódios de diarréia aguda tornavam-se persistentes, porém um estudo epidemiológico mais recente realizado em uma comunidade brasileira evidenciou que esta taxa caiu para 1,4%. A diarréia persistente apresenta alto impacto nas taxas de morbidade e mortalidade nas populações pediátricas dos países em desenvolvimento e mais de 50% das mortes por diarréia estão associadas à persistência da mesma. A maioria das mortes costuma atingir crianças de tenra idade, que vivem nas regiões rurais, em condições de pobreza extrema e desprovidas de saneamento básico. A persistência da diarréia devido a uma disfunção digestivo-absortiva provoca agravo nutricional pondero-estatural, bem como futuro rebaixamento das funções cognitivas e intelectuais, que irão prejudicar o desempenho escolar e conseqüentemente limitando de forma inexorável todo um porvir pessoal e profissional.
Definição
Diarréia Persistente (DP) foi definida pela Organização Mundial da Saúde (OMS), em 1987, como uma síndrome diarréica de causa presumivelmente infecciosa que se inicia como um episódio agudo e que se prolonga de forma não usual, por um período igual ou superior a 14 dias, acarretando agravo do estado nutricional e alto risco de morte. O termo não inclui as formas potencialmente crônicas ou recorrentes de diarréia, como o sprue tropical, doença celíaca, fibrose cística e outras afecções hereditárias com manifestações diarréicas. A utilização deste “ponto de corte” de 14 dias de duração para distinguir diarréia aguda da DP se justifica pelo fato de que as taxas de mortalidade observadas em crianças com diarréia de até 14 dias sobem de 0,8% para 14%, quando a duração do episódio diarréico supera este período de dias.
A Figura 8 é um típico exemplo de um paciente portador de DP grave com alto risco de morte atendido na Unidade Metabólica “Horácio Toccalino” do Hospital Umberto I da qual fui chefe na década de 1980 até seu fechamento em 1993 (Figuras 9 – 10 & 11). A partir deste capítulo nós seguiremos a saga de A, na sua desesperada luta para sobreviver à esta guerra que foi deflagrada em seu intestino mas que afetou seu organismo integralmente. Não desejo fazer suspense, por isto desde já antecipo que A, com o auxílio de extraordinária equipe de saúde e sua férrea vontade de viver, venceu brilhantemente esta dramática batalha contra um microorganismo invasor, como será demonstrado com o passar dos capítulos.

Figura 9- Minha foto tirada da porta de entrada da Unidade Metabólica que homenageou meu querido e saudoso mestre Horácio Toccalino.
Histórico
Diarréia Persistente (DP) foi primeiramente descrita por Avery e cols. (Pediatrics 41:712-22, 1968) sob a denominação de Diarréia Intratável, o que conferia a esta entidade clínica uma conotação absolutamente fatalista, indicando um prognóstico praticamente fechado dada a gravidade do quadro clínico, em virtude da extrema limitação dos recursos terapêuticos existentes à época (vale lembrar que o emprego da nutrição parenteral somente passou a estar disponível a partir da década de 1970), em face da inexistência dos conhecimentos fisiopatológicos íntimos do processo diarréico em questão, o que acarretou uma elevada taxa de mortalidade nesta série, em 40% dos casos. Sem dúvida alguma, este trabalho original teve a enorme importância de despertar o interesse dos clínicos e pesquisadores para um grupo de pacientes que pertenciam a uma faixa etária precoce da vida, cujas complicações nutricionais advindas do prolongamento da diarréia e da má absorção dos nutrientes da dieta, mostravam-se extremamente graves com alto risco de morte (Figura 1).
Hyman e cols. (J. Pediatrics 78: 17-19, 1971) introduziram o termo Diarréia Protraída (Prolongada) levantando a suspeita de que esta síndrome seria provocada por intolerância à proteína do leite de vaca e relataram a experiência adquirida com a utilização inicial de Nutrição Parenteral Total (NPT), para logo a seguir utilizar dieta à base de Hidrolisado Protéico extensivamente hidrolisado. Lloyd-Still e cols. (Am. J. Dis. Child. 125: 358-64, 1973) descreveram intensas alterações morfológicas do intestino delgado à microscopia óptica comum mas, embora não tenham identificado a etiologia do processo diarréico, demonstraram que estas lesões eram reversíveis quando utilizavam NPT por tempo prolongado, com jejum oral absoluto. Estes achados foram posteriormente confirmados por Banister e cols. (Acta Paediatr. Scand. 64: 732-40, 1975) bem como por Greene e cols. (J. Pediatr. 78: 695-704, 1975) os quais também obtiveram excelentes resultados com o emprego da NPT. Por sua vez, Larcher e cols. (Arch. Dis. Child. 52: 597-605, 1977) descreveram à época a maior casuística de DP dando especial ênfase à etiologia e propuseram medidas dietéticas para o manuseio dos pacientes, eliminando as fórmulas lácteas, e introduziram uma dieta líquida à base de carne de frango, com êxito indiscutível. Este trabalho teve o grande mérito, naquela ocasião, de servir como exemplo de conduta dietética alternativa de sucesso para os mais diversos países do globo terrestre, em especial para os países em desenvolvimento, que não dispunham de fórmulas à base de hidrolisado protéico, pois se tratava de uma fórmula de baixo custo e de fácil elaboração. Fagundes-Neto e cols. (Arquivos de Gastroenterol 16: 205-8, 1975) descreveram o caso de um paciente com DP causada por uma cêpa de Escherichia coli O111 que provocou invasão da mucosa do intestino delgado (Figuras 2 – 3 – 4 & 5) e acarretou intolerância alimentar múltipla inclusive aos monossacarídeos da dieta. O paciente foi submetido à NPT e após 2 semanas de internação voltou a tolerar alimentação por via oral e também demonstrou recuperação da lesão morfológica do intestino delgado (Figura 6).
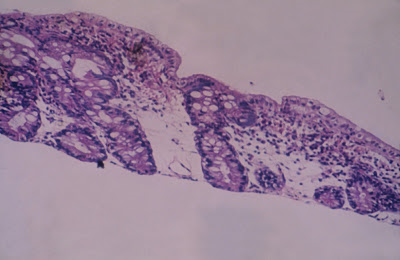
Figura 2- Microfotografia do material de biópsia do intestino delgado do paciente evidenciando nítida atrofia vilositária sub-total e aumento do infiltrado inflamatório na lâmina própria.
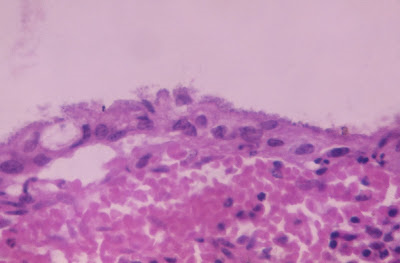
Figura 3- Microfotografia em maior aumento do material de biópsia do intestino delgado do paciente mostrando a presença de nichos bacterianos firmemente aderidos à superfície epitelial com transformação cuboidal dos enterócitos. Na lâmina própria, logo abaixo da membrana basal nota-se um infiltrado hemorrágico.
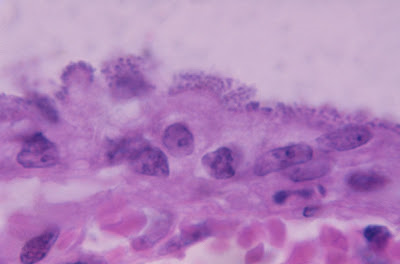
Figura 4- Microfotografia em imersão do material de biópsia do intestino delgado do paciente evidenciando nichos bacterianos firmemente aderidos à superfície dos enterócitos, os quais se acham intensamente alterados quanto a sua morfologia.
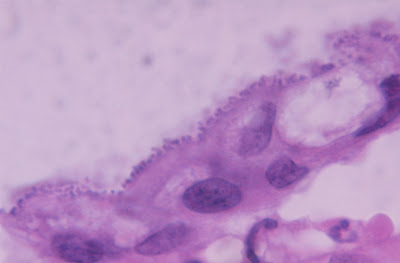
Figura 5- Microfotografia em imersão do material de biópsia do intestino delgado do paciente evidenciando arrancamento dos enterócitos que se acham totalmente distorcidos e a presença de nichos bacterianos em sua superfície.
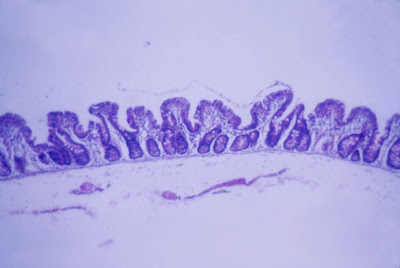
Figura 6- Microfotografia do material de biópsia do intestino delgado do paciente após ter cessado a diarréia e normalização da aceitação da dieta por via oral mostrando recuperação morfológica. As vilosidades intestinais ainda se encontram encurtadas evidenciando uma atrofia vilositária parcial mas em nítido processo de recuperação da estrutura morfológica.
Rothbaum e cols. (Gastroenterology 83: 441-54, 1982) demonstraram, por meio da microscopia eletrônica de transmissão, a clássica lesão em pedestal provocada por uma cêpa de Escherichia coli O119 em um grupo de lactentes com DP (Figuras 7 – 8 – 9 & 10).
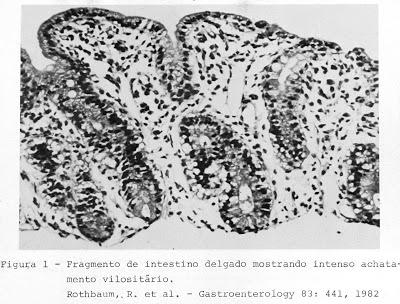
Figura 7- Vide legenda acima.
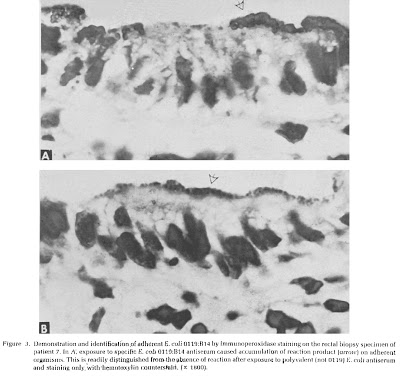
Figura 8- Nichos bacterianos de Escherichia coli O 119 firmemente aderidos à superfície dos enterócitos. Nota-se a mesma anormalidade descrita em nosso paciente.
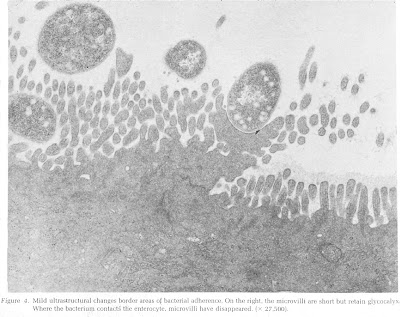
Figura 9- Ultramicrofotgrafia do material de biópsia do intestino delgado evidenciando destruição das microvilosidades e a formação da lesão em pedestal pela bactéria.
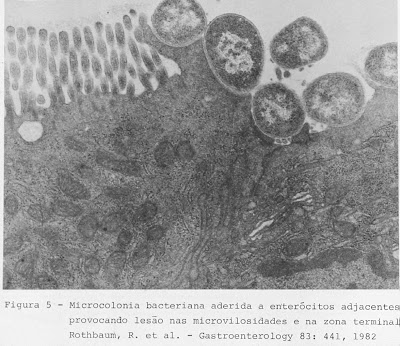
Figura 10- Vide legenda acima.
Fagundes-Neto e cols. (J. Pediatr. Gastroenterol. Nutr. 4: 714-22, 1985) descreveram aspectos clínicos e ultraestruturais do epitélio do intestino delgado de lactentes portadores de DP (Figuras 11 – 12 & 13).
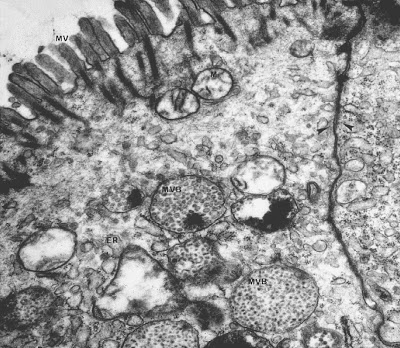
Figura 11- Ultramicrofotografia de material de biópsia do intestino delgado de um paciente nosso portador de DP evidenciando profundas alterações estruturais dos enterócitos. As microvilosidades estão achatadas e diminuidas em número; as mitocôndrias estão inchadas e distorcidas e há um aumento significativo dos corpos multivesiculares (mvb) no interior do citoplasma denotando a penetração maciça de proteínas intactas.
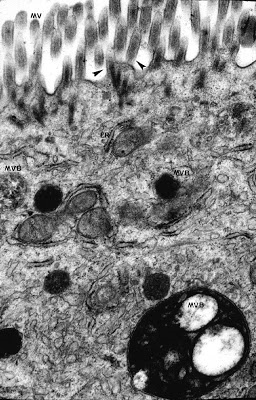
Figura 12- Ultramicrofotografia do material de biópsia do intestino delgado de um paciente nosso portador de DP evidenciando as microvilosidades tendendo a formar tufos (setas); no interior do citoplasma observam-se retículos endoplasmáticos preservados (er), bem como as mitocôndrias e inúmeros corpos multivesiculares (mvb).
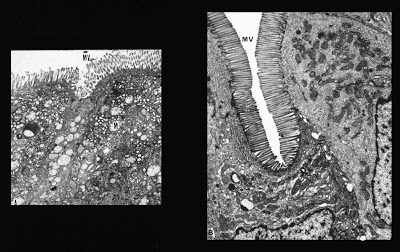
Figura 13- Ultramicrofotografia do material de biópsia do intestino delgado de um nosso paciente portador de DP em 2 momentos distintos da sua evolução: 1- à esquerda durante o período de estado da doença podem-se observar profundas anormalidades na morfologia do enterócito, havendo destruição das microvilosidades, e no interior do citoplasma não se pode identificar as organelas devido a intensa vacuolização das mesmas; 2- à direita após a recuperação clínica e nutricional evidenciando normalização da estrutura morfológica do enterócito; as microvilosidades se mostram íntegras e as organelas intracitoplasmáticas totalmente identificadas e normalizadas.
Considerando a importância global desta síndrome a Organização Mundial da Saúde, em 1987, após extensa discussão sobre o tema, decidiu expedir um memorando, dando um rótulo diagnóstico para esta síndrome, ao mesmo tempo em que chamava especial atenção para aquelas situações clínicas, as quais presumivelmente tivessem tido uma origem infecciosa e que se perpetuaram por diferentes razões, causando desnutrição e altas taxas de mortalidade.
Enquanto continuo discorrendo sobre a potencial gravidade da DP, nosso sofrido paciente A ainda se encontra na Unidade de Cuidados Intensivos, monitorado em seus sinais vitais e recebendo as reposições hidroeletrolíticas necessárias, para a preservação da sobrevivência, posto que o processo diarréico secretor ainda se mantivesse intenso, devido à infecção causada pela cepa de Escherichia coli O111, associado a um fator osmótico em decorrência a intolerâncias alimentares múltiplas, o que nos obrigou a empregar a NPT por um tempo prolongado (Figuras 14 & 15).
Fatores de Risco para a ocorrência de Diarréia Persistente (DP)
A evolução de um episódio de diarréia aguda para persistente depende fundamentalmente de circunstâncias que envolvem a interação entre o hospedeiro, o agente agressor e seu meio ambiente. No que diz respeito ao hospedeiro os principais fatores predisponentes para a perpetuação da diarréia estão ligados à ausência da prática do aleitamento natural exclusivo por tempo prolongado, função imunológica deficiente, desnutrição protéico-calórica e idade precoce. Com relação ao agente agressor, algunsmicroorganismos enteropatogênicos apresentam maior capacidade de provocar danos funcionais e morfológicos à mucosa intestinal e, portanto, são potencialmente mais predisponentes a causar o prolongamento do processo diarréico. Do ponto de vista do meio ambiente os baixos níveis sócio-econômico-educacionais dos pais ou cuidadores, hábitos de higiene alimentar precários, insalubridade da água e deficiência, ou mesmo ausência, da rede de esgotos, são fatores extremamente importantes que contribuem para a ocorrência da DP.
Etiopatogenia
Vários agentes etiológicos causadores de Diarréia Aguda têm sido envolvidos na gênese da DP, tais como: Escherichia coli enteropatogênica (EPEC),Escherichia coli enteroagregativa (EAEC), Salmonella, Shigella, Campylobacter, Cryptosporidium, Giárdia, Norovirus e Rotavirus,dependendo das características geográficas, sasonais, ambientais e das especificidades das populações estudadas. No nosso meio os agentes etiológicos mais frequentemente descritos como causadores de DP são as diversas cepas deEPEC e EAEC. Por este motivo, no presente manuscrito dedicarei particular atenção a estes 2 tipos de microorganismos enteropatogênicos (Figura 1).
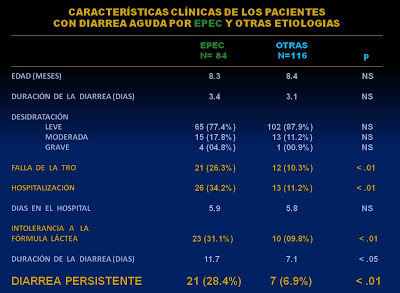
Figura 1- A importância no nosso meio das cêpas de EPEC como causa de Diarréia Persistente.
EPEC
No nosso meio os sorogrupos de EPEC O111 e O119 representam aproximadamente 80% de todos os sorogrupos (são cerca de 20) isolados em crianças com diarréia. A Escherichia coli foi descoberta, em 1885, pelo Pediatra alemão Theodore Escherich que a denominou Bacterium coli commune, e a razão de utilizar esta terminologia foi para indicar sua ocorrência universal no intestino grosso dos indivíduos saudáveis. Entretanto, o próprio Escherich já suspeitava que a E. coli pudesse agir como agente enteropatogênico para o ser humano, quando por alguma razão estivesse deslocada do seu habitat natural, ou seja fora do intestino grosso. Para confirmar tal suspeita, este pesquisador demonstrou a patogenicidade da E. coli ao injetar um caldo de cultura da mesma em alças intestinais isoladas de coelho, provocando grande acúmulo de secreção de fluidos e eletrólitos. No entanto, o primeiro cientista a comprovar cabalmente a associação de cepas antigenicamente homogêneas de E. coli como causadoras de diarréia foi o Microbiologista John Bray, em 1945, na Inglaterra. Bray, trabalhando em colaboração com o Pediatra Thomas Beaven e com o Biólogo Stevenson, descreveu um surto de diarréia em lactentes internados no Hillingdon Hospital, Uxbridge, provocado por um novo agente enteropatogênico que apresentava elevada capacidade de virulência e que causou altas taxas de mortalidade (Figura 2).

Figura 2- Placa comemorativa a John Bray pela descrição da Escherichia colienteropatogênica.
Vale a pena recordar que até aquela data somente eram conhecidos 3 agentes enteropatogênicos, a saber: Vibrio cholera, Salmonella e Shigella. Desta forma, o até então denominado Bacterium coli, passou a ser incorporado na lista dos agentes provocadores de diarréia, porém com uma característica especial, afetava crianças de baixa idade e provocava alta taxa de letalidade. Foi Kauffman, em 1947, o responsável pela mudança do nome de Bacterium coli paraEscherichia coli, em homenagem ao seu descobridor o Pediatra alemãoTheodore Escherich. Kauffman também foi o responsável pela caracterização dos diferentes grupos sorológicos da E. coli por meio da determinação dos antígenos O (somático), K (capsular) e H (flagelar) (Figura 3).

Figura 3- Grupos sorológicos de Escherichia coli.
A partir do esquema de classificação proposto por Kauffman constatou-se que a bactéria isolada por Bray e a amostra Aberdeen alfa, isolada por Giles em um surto de diarréia em lactentes naquela localidade, na Escócia, eram na realidade aE. coli O111. Estudos realizados por Kauffman e Du Pont em crianças portadoras de diarréia, no período de 1945 a 1950, em várias partes do mundo, mostraram que as E. coli isoladas pertenciam aos sorogrupos O55 e O111. No Brasil, foi o microbiologista Luis Rachid Trabulsi o pioneiro em descrever as cepas de E. coli causadoras de diarréia em crianças. Professor Trabulsi e cols., em 1961 (Ver. Inst. Med. Trop. São Paulo 3, 267) estudaram 80 crianças com diarréia, internadas no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, tendo sido isolados em 17 delas colibacilos enteropagênicos, com predomínio das E. coli O119, O126, O26, O55 e O111.
A descoberta de Bray e seus colaboradores foi um avanço científico de enorme importância e, ainda que tardiamente, valeu o reconhecimento dos seus sucessores no Hillingdon Hospital, pois somente em 1968 foi realizado um evento em homenagem aos autores em referência a aquela descoberta. Naquela ocasião foi confeccionada uma placa comemorativa para celebrar a grande descoberta deBray, que lá esteve presente juntamente com Beaven e Stevenson (Figura 4).

Figura 4- O Microbiologista John Bray (esquerda), o Pediatra Thomas Beavan (centro) e o Biólogo J. Stevenson (direita) no dia da homenagem em 1968.
Bray pode, então, contar com riqueza de detalhes todas as dificuldades, as frustrações e as dramáticas situações com as quais tiveram de conviver durante o período de aproximadamente 5 anos desde sua chegada ao hospital até finalmente poder confirmar cabalmente a existência deste novo agente enteropatogênico. Este relato está publicado na revista Archives of Disease in Childhood 48; 923-26, 1973, e vale a pena ser parcialmente transcrito para que se tenha uma idéia mais precisa do que representa a obstinada luta de um pesquisador para alcançar um determinado objetivo. Com a palavra John Bray: “Quando eu fui contratado pelo Hillingdon Hospital para trabalhar como patologista no Serviço de Emergência, em 1939, no começo da II Guerra Mundial, uma das minhas tarefas era realizar as necrópsias dos pacientes que faleciam no hospital. Eu supus que teria um grande trabalho com os falecimentos em decorrência dos bombardeios que a Inglaterra sofria naquela época. Entretanto, felizmente esta situação não ocorreu, mas logo me dei conta de que havia um grande número de óbitos de lactentes que recebiam aleitamento artificial. Estes lactentes faleciam devido a gastroenterite, os quais apresentavam uma característica que chamava minha atenção. Em um primeiro momento estas crianças aparentemente não apresentavam maior gravidade mas dentro de uma ou horas mais tarde encontravam-se agonizantes. Para minha surpresa os exames bacteriológicos das fezes não revelavam nenhum dos agentes enteropatogênicos conhecidos na época; tudo que era encontrado nas placas de cultura das fezes era Bacterium coli considerado da flora colônica normal, e além disso a necrópsia não revelava qualquer achado de valor diagnóstico que pudesse justificar a morte daquelas crianças. Entretanto, em um determinado dia Dr. Beavan veio ao meu laboratório e fez o seguinte comentário: ”Você sabe, eu consigo identificar estes casos de gastroenterite assim que eles são internados, porque eles exalam um odor característico de esperma”. Não fiz qualquer observação a respeito mas esta era a dica que eu estava esperando, porque desde a primeira placa de cultura, dentre as inúmeras que costumava realizar, que eu havia pego da bancada de um caso de gastroenterite e que evidenciava uma flora aparentemente normal, exalava um forte odor espermático, mas que era rapidamente evanescente. Decidi, então, levar para a enfermaria 2 placas de cultura, uma com Proteus, bactéria pertencente à flora fecal normal, que exala um forte odor caracterísitco, e uma outra de Bacterium coli com odor espermático, como costumávamos designar a E. coli à época. Entreguei as duas placas à enfermeira que cuidava dos pacientes com gastroenterite para que ela as cheirasse; quanto à cultura de Proteus ela disse que tinha um odor parecido a cola, mas quando ela cheirou a outra, imediatamente exclamou: “ela cheira igualzinho ao bebê Wickens”. Então eu retruquei, esta é a cultura de fezes do bebê Wickens, e, naquele exato momento, tive a certeza que havia solucionado o problema e um novo agente enteropatogênico estava sendo descoberto. A partir daí não podia apenas me ater em estabelecer o diagnóstico pelo odor exalado da placa da cultura de fezes, era necessário avançar e para tal era necessário elaborar um anti-soro que aglutinasse com esse tipo de bactéria. Para tal eu injetei a cultura de fezes do bebê Wickens (que infelizmente veio a falecer) na veia da orelha de um coelho, e, assim obtive um anti-soro. A partir daí tive que realizar inúmeros testes de aglutinação com diferentes cepas de Bacterium coli isoladas das fezes de indivíduos normais e com diarréia para poder comprovar minha suspeita. Este trabalho tomou-me muito tempo e estendeu-se por um período de 4 anos, nem sempre com resultados animadores, e, em muitos momentos provocando-me grandes frustrações, porque as aglutinações nem sempre ocorriam como o esperado. Porém, após muita insistência meu anti-soro passou a reagir de forma consistente com os micro-organismos isolados das fezes das crianças com gastroenterite, e eu me permito afirmar que isto foi um verdadeiro triunfo para controlar esta doença potencialmente fatal. O teste passou a ser um meio rapidamente efetivo para diferenciar os casos de diarréia por E. coli daqueles outros de origem irrelevante. Pela primeira vez o médico passou a ser capaz de diferenciar os casos de diarréia infecciosa grave daqueles observados em crianças saudáveis. É possível que nos dias atuais existam melhores métodos diagnósticos, mas naquela época este teste revelou-se algo absolutamente novo. Em conclusão, atualmente o micro-organismo isolado teve sua estrutura antigênica mais detalhadamente examinada e foi denominado Escherichia coli O111:B4. A cepa O111:B4 Wickens original ainda está conosco, e permanece com seu poder de causar gastroenterite em lactentes, mas os dias nos quais milhares de crianças no Reino Unido morriam a cada ano desta enfermidade já não existem mais”.
A descoberta de Bray e Beavan nos deixa inúmeros ensinamentos, além do próprio mérito científico, que por si só se revelou de importância clínica inestimável (Figura 5).
Em primeiro lugar, nos ensina o quão importante é levar em consideração a observação acurada dos mínimos detalhes para se alcançar grandes descobertas, no caso além dos conhecimentos de bacteriologia, existentes na época, foi a partir do uso de um órgão do sentido, o olfato, que se abriu todo um novo caminho para o sucesso da pesquisa em questão; em segundo lugar, o trabalho associativo com um colega de outra disciplina, o Pediatra, o profissional da saúde que vive intensamente à beira do leito o drama do seu paciente que sofre de uma enfermidade que aparentemente não pode ser debelada, mas que nem por isso deixa de buscar uma solução para salvar a vida daquele ser gravemente enfermo, mesmo tendo que vivenciar inúmeras frustrações na sua luta entre a doença e a busca incessante da saúde; em terceiro lugar, valorizar a enfermeira acreditando ser ela uma profissional tão envolvida quanto quaisquer outros no cuidado do paciente a ponto de demonstrar sua capacidade de perceber nitidamente as diferenças organolépticas entre os micro-organismos que cresceram na placa de cultura. Infelizmente, o que ainda persiste a ocorrer nos países em desenvolvimento é a realidade que Bray vivenciou nos anos 1940 na Inglaterra, e que continua a ser o desafio enfrentado em muitas frentes de batalha, tanto nos avanços da intimidade do processo infeccioso causado pelas cepas de EPEC quanto na melhor abordagem diagnóstica e terapêutica, como continuaremos a descrever no nosso próximo encontro.
Escherichia coli enteropatogênica: mecanismos de patogenicidade
Cravioto e cols., em 1979 (Curr Microbiol 3:95-9), descreveram uma propriedade característica das EPEC a qual se manifesta por uma adesão localizada quando estes microorganismos são expostos em cultura de tecido às células Hep-2 ou HeLa (Figura 1).
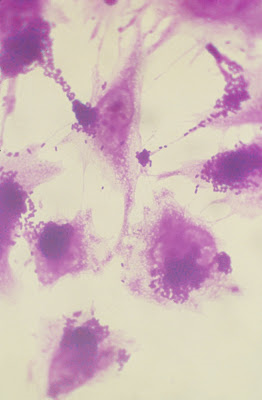
Figura 1- Típica adesão localizada de uma cepa de Escherichia colienteropatogênica em cultura de células HeLa.
Este padrão de adesão localizada é determinado por um plasmídeo que foi denominado EAF (Escherichia coli adherence factor). Vale ressaltar que plasmídeo é um material genético extra-cromossômico e como tal pode ser transferido de bactéria a bactéria através da conjugação sexual, e, portanto, esta propriedade pode ser adquirida por um novo microorganismo até então desprovido da capacidade de provocar adesão localizada. Giron e cols., em 1991 (Science 254:710-13), identificaram o fator responsável pela mediação da adesão localizada; estes autores descreveram fímbrias de 7nm de diâmetro produzidas pelas cepas deEPEC, as quais têm a tendência de se agregar e formar bandas, e por isso foram denominadas “bundle-forming pilus” (BFP) (Figura 2).
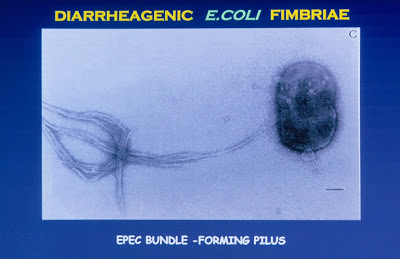
Figura 2- Ultramicrofotografia de uma Escherichia coli enteropatogênica e suas fímbrias.
Além destas propriedades específicas das cepas de EPEC deve-se agregar outro mais, a que representa a marca histopatológica característica sobre o epitélio do intestino delgado das infecções por EPEC, ou seja, a lesão denominada“attaching-and-effacing” (AE) (aderência e desaparecimento) (Figura 3) que foi pela primeira vez descrita em crianças portadoras de diarréia persistente por Rothbaum e cols., em 1982 (Gastroenterology 83:441-54).
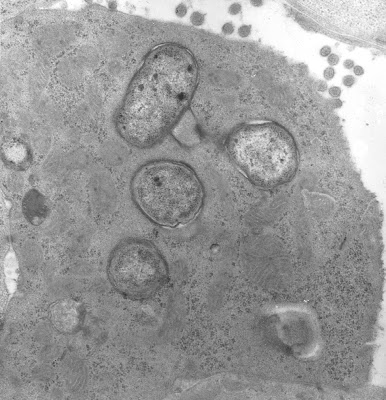
Figura 3- Ultramicrofotografia de um enterócito mostrando vários microorganismos “sentados” sobre a superfície epitelial.
A íntima adesão da bactéria com a membrana do enterócito causa uma ruptura da porção apical do citoesqueleto e dá a nítida aparência de que a bactéria encontra-se “sentada” sobre um pedestal da membrana celular (Figura 4).
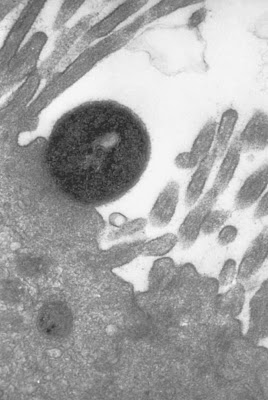
Figura 4- Ultramicrofotografia de um enterócito demonstrando a característica lesão em pedestal.
Esta íntima adesão AE é codificada por um gene denominado “Escherichia coliattaching-effacement” (eae) e efetuada pela produção de uma proteína denominada intimina (Figura 5).
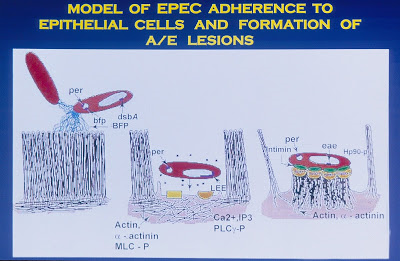
Figura 5- Modelo esquemático do mecanismo de patogenicidade da Escherichia colienteropatogênica.
Posteriormente, Fagundes-Neto e cols., em 1995 (Acta Paediatr 84:453-5), descreveram a capacidade de uma cepa de Escherichia coli O111:H2 de penetrar o epitélio intestinal de uma criança portadora de diarréia aguda. Tratou-se de um lactente de 11 meses de idade internado no Hospital Universitário de Brasília com diarréia de 5 dias de duração, associada a vômitos e febre; o paciente encontrava-se assintomático até o início de um quadro de diarréia aquosa profusa que acarretou desidratação moderada. Inicialmente o paciente foi tratado na sala de urgência tendo recebido terapia de reidratação oral, porém como o processo diarréico se acentuou associado a acidose metabólica o paciente foi internado na enfermaria para receber hidratação intravenosa e correção do distúrbio metabólico. A cultura de fezes revelou a presença de Escherichia coli O111:H2 e o mesmo agente enteropatogênico foi isolado na cultura da secreção jejunal. No quinto dia de internação devido à má evolução clínica o paciente foi submetido à biópsia jejunal, cuja avaliação à microscopia óptica comum revelou atrofia vilositária sub-total associada a nichos de bactérias Gram – firmemente aderidas à porção apical dos enterócitos. A análise à microscopia eletrônica de transmissão revelou a presença de bactérias aderidas à superfície apical dos enterócitos com formação de pedestal e penetração das mesmas no interior dos enterócitos. O paciente apresentou intolerância alimentar múltipla e necessitou ser alimentado com fórmula à base de hidrolisado protéico, a qual foi bem tolerada. Após 15 dias de internação o paciente recebeu alta hospitalar curado do episódio diarréico (Figuras 6 – 7 – 8 – 9 – 10).
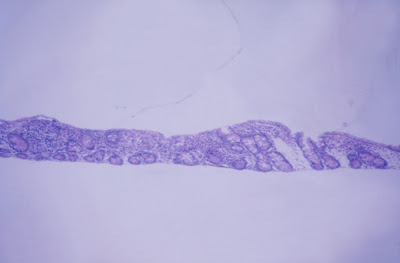
Figura 6- Microfotografia de material de biópsia do intestino delgado revelando atrofia vilositária sub-total.
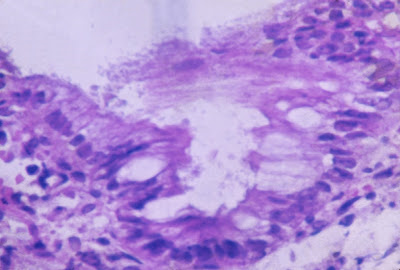
Figura 7- Microfotografia em maior aumento de material de biópsia de intestino delgado mostrando nichos de bactéria sobre o epitélio do intestino delgado.
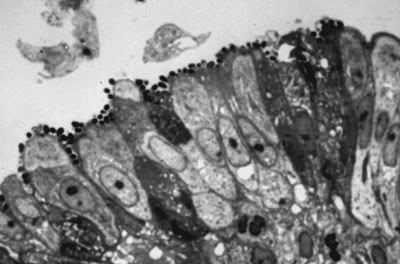
Figura 8- Microfotografia em corte semifino do intestino delgado evidenciando nichos de Escherichia coli O111:H2 firmemente aderidos à superfície epitelial dos enterócitos.
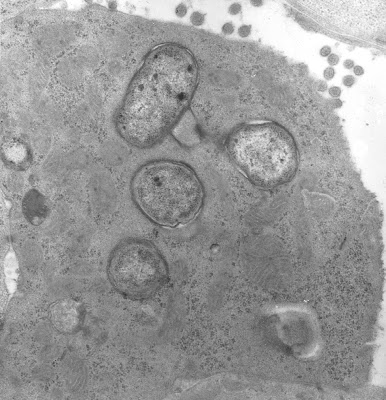
Figura 9- Ultramicrofotografia de um enterócito evidenciando a presença microorganismos de Escherichia coli O111:H2 no seu interior.
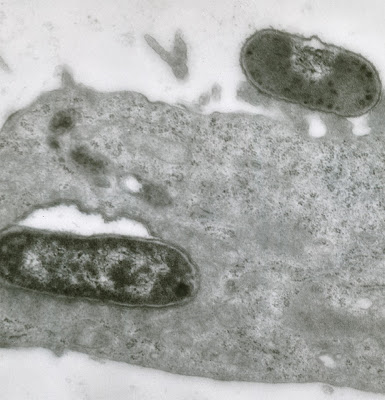
Figura 10- Ultramicrofotografia da infecção de uma célula HeLa pela cepa deEscherichia coli O111:H2. Notar a presença de um microorganismo no interior da célula e outro na porção apical da célula HeLa com formação de pedestal.
Em resumo podemos afirmar que a patogenicidade da EPEC se dá em um modelo de 3 estágios, a saber: 1- adesão localizada que representa a interação inicial entre a bactéria e a célula epitelial, a qual é mediada pelas fimbrias mas também envolve lócus cromossômicos e plasmidiais; 2- genes cromossômicos iniciam um sinal de transdução que resultam na liberação intracelular de Cálcio e conseqüente desaparecimento das microvilosidades; 3- a interação da intimina e produtos do gene eae que causarão a firme adesão da bactéria ao enterócito formando a lesão em pedestal.
Escherichia coli enteroagregativa: mecanismos de patogenicidade
Escherichia coli enteroagregativa (ECEA) constitui um conjunto de bactérias que abrange sorogrupos de Escherichia coli que aderem a linhagens celulares “in vitro”, tais como células HeLa e HEp-2, formando agregados bacterianos, localizados na superfície celular e em regiões da lamínula isenta de células, em um arranjo semelhante a “tijolos empilhados”. A configuração “em pilha de tijolos” (stacked bricks) é considerada condição obrigatória para o padrão típico de aderência agregativa (AA).
Nataro e cols., em 1987 (Pediatr Infect Dis J 6:829-31), investigou as propriedades de adesão em células HEp-2 de determinadas cepas de Escherichia coli que foram isoladas das fezes de 154 crianças com diarréia e 66 controles em Santiago, Chile. No desenrolar da pesquisa, os autores puderam subdividir os fenótipos de adesão em duas categorias, a saber: agregativa e difusa (AD) (Figuras 1 & 2).
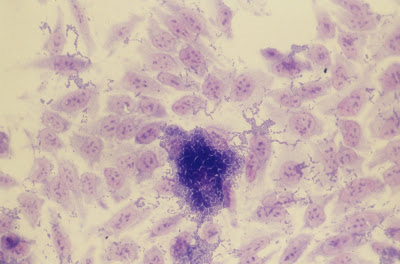
Figura 1- Cepa de Escherichia coli em cultura de célula HeLa evidenciando adesão agregativa, tipicamente “em pilha de tijolos”.
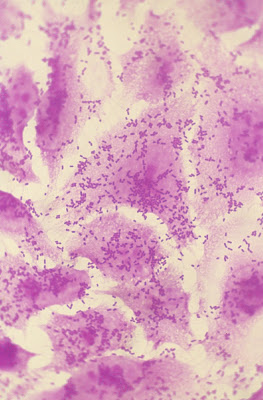
Figura 2- Cepa de Escherichia coli em cultura de célula HeLa evidenciando Adesão Difusa.
A AA se distinguia devido a uma proeminente autoaglutinação das células bacterianas quando cultivadas com células HEp-2, em uma forma característica que foi denominada “stacked brick”. Na AD as bactérias eram visualizadas de forma dispersa sobre a superfície das células HEp-2. Dentre as 253 cepas bacterianas deEscherichia coli, dos pacientes chilenos com diarréia, que não se hibridizavam quando submetidas ao estudo com a sonda EAF (padrão clássico do fator de adesão localizada) 84 (33%) delas exibiam o padrão AA de adesão, enquanto que das 134 cepas de Escherichia coli, sondas negativas para o fator EAF do grupo controle, somente 20 (15%) revelaram-se AA positivas. Esta diferença entre pacientes e controles mostrou-se altamente significativa (p<0)
Escherichia coli causadoras de diarréia receberam inicialmente o termo Escherichia colienteroaderente-agregativa, o qual posteriormente, por questões de simplificação, foi encurtado para Escherichia coli enteroagregativa (ECEA).
Evidências experimentais concluíram que a infecção por cepas de ECEA vem acompanhada por efeitos citotóxicos sobre a mucosa intestinal. Análises histopatológicas do intestino de pacientes infectados por ECEA e modelos animais têm trazido importantes contribuições para um melhor entendimento da patogênese desta enfermidade. Nataro & Sears, em 1996 (Infect Immun 64:4761-68) demonstraram que a cepa O42 de ECEA tem a capacidade de produzir efeitos citotóxicos sobre as células T84 (células de carcinoma intestinal humano) (Figura 3).
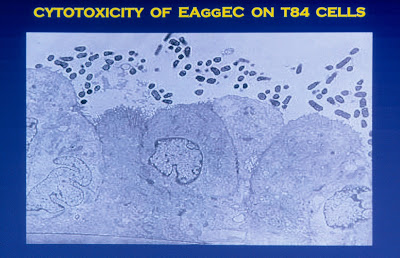
Figura 3- Efeito citotóxico da cepa de Escherichia coli agregativa O42 sobre células carcinomatosas intestinais humanas.
Recentemente, Andrade, Happalainen & Fagundes-Neto, em 2010 (Arquivos de Gastroenterologia 47: 306-12), investigaram a interação de 3 cepas de ECEA isoladas das fezes de crianças com diarréia persistente com as mucosas ileal e colônica de seres humanos, in vitro, utilizando as microscopias eletrônicas de transmissão e varredura. Foram estudadas as seguintes cepas de ECEA: 171-1, 101-1 e 71-1; o protótipo O42 foi utilizado como controle positivo e como controle negativo foram utilizados fragmentos intestinais desprovidos de infecção. A análise dos fragmentos intestinais à microscopia eletrônica de transmissão revelou destruição da superfície epitelial e adesão das bactérias aos enterócitos com todas as cepas investigadas (Figuras 4 -5 & 6).
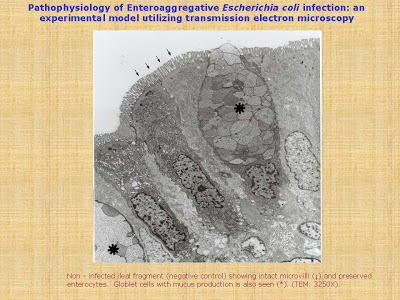
Figura 4- Vide texto no slide.
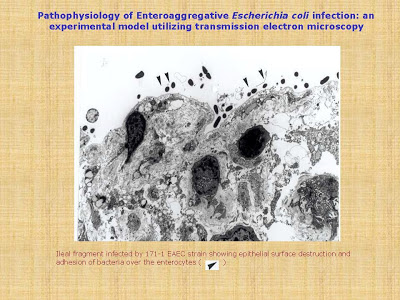
Figura 5- Vide texto no slide.
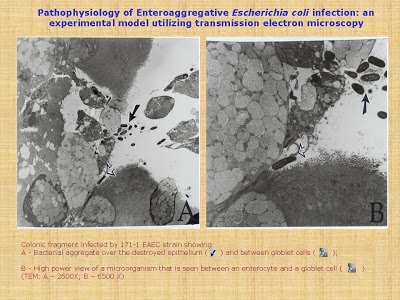
Figura 6- Vide texto no slide.
A análise dos fragmentos intestinais á microscopia eletrônica de varredura revelou a formação de agregados bacterianos, “em pilha de tijolos”, firmemente aderidos à uma camada de muco recobrindo a mucosa acarretando destruição das microvilosidades. Além disto, também foram observadas formações de fimbrias que emergiram a partir do corpo das bactérias interagindo com as células intestinais (Figuras 7 – 8 – 9 -10 & 11).
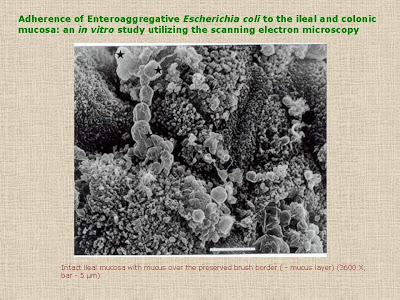
Figura 7- Vide texto no slide.
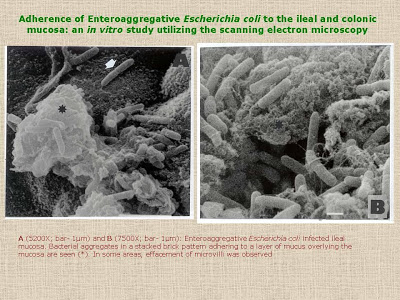
Figura 8- Vide texto no slide.

Figura 9- Vide texto no slide.

Figura 10- Vide texto no slide.

Figura 11- Vide texto no slide.
Os autores confirmaram que as cepas de ECEA têm a capacidade de colonizar tanto o intestino delgado quanto a mucosa colônica e que a infecção causada por estas cepas têm a propriedade de provocar lesão ao epitélio absortivo do intestino delgado dando lugar à perpetuação da diarréia.
Vale ressaltar que esta categoria de Escherichia coli tem apresentado comportamento bastante heterogêneo em vários aspectos fenotípicos e genotípicos, e não se sabe, até o presente momento, se esta diversidade ocorre em cada tipo de variante ou se ela pode ser atribuída ao fato de se realizar uma análise conjunta da patogenicidade de amostras típicas e variantes. Portanto, este grupo de bactérias apresenta tanto cepas patogênicas quanto cepas não patogênicas, daí o porquê também terem sido isoladas nas fezes de indivíduos assintomáticos. Estudos realizados em diferentes locais do mundo têm revelado associação de ECEA com diarréia persistente em percentuais que variam desde 10% até mesmo a 68%. Este por exemplo é o caso do estudo de Fang e cols., em 1995 (J Pediatr Gastroenterol Nutr 21:137-44), realizado no nordeste do Brasil, em que os autores revisaram 4800 casos de doença diarréica e selecionaram 56 crianças com diarréia persistente, 52 com diarréia aguda e 42 controles. Neste grupo de estudo cepas de ECEA foram isoladas em 68% dos casos de diarréia persistente, 46% dos casos de diarréia aguda e 31% dos controles. Por outro lado Bardhan e cols., em 1998 (J Pediatr Gastroenterol Nutr 26:9-15), em Bangladesh, Índia, estudaram 195 crianças, das quais 135 com diarréia persistente, 42 com diarréia aguda e 15 controles. ECEA foi isolada nas fezes de 25,4% das crianças com diarréia persistente, e os autores concluíram que ECEA é um importante agente enteropatogênico associado à diarréia persistente.
Manifestações Clínicas
Tanto as cepas de EPEC como aquelas de ECEA causam diarréia aquosa profusa e embora a enfermidade apresente evolução autolimitada, o processo secretor intestinal pode se prolongar e, mesmo na ausência de intolerâncias alimentares, as perdas hídricas e eletrolíticas podem perdurar por mais de 14 dias, conforme demonstram os estudos de balanço metabólico realizados por Garcia e cols., em 1997 (Rev Ass Med Brasil 43:283-9). Neste estudo realizado com pacientes hospitalizados nos quais os seguintes sorogrupos de Escherichia coli enteropatogênica foram identificados na cultura de fezes: O11, O111, O119, O55 e O127, as perdas hídricas fecais foram monitoradas em cama metabólica, o que permitiu coletar separadamente as perdas fecais das urinárias nos lactentes do sexo masculino,foram em média de 80,6 mL/kg de peso no primeiro dia e de 47,6 mL/kg de peso no décimo primeiro dia de estudo. Dentre os 38 pacientes estudados, 18 (47,4%) mantinham o quadro diarréico após o décimo dia de doença e 7 (18,4%) após o décimo quarto dia (Figura 1).
Vale a pena ressaltar que houve casos em que as perdas fecais diárias chegaram a alcançar a cifra de 220 mL/kg de peso, o que demonstra a importância das cepas de EPEC como causadoras de casos graves de diarréia em lactentes de baixa idade. Os valores dos volumes fecais diários mostraram diferenças significativas de acordo com o tipo de dieta utilizada. Aqueles pacientes que necessitaram receber nutrição parenteral, porque apresentaram intolerâncias alimentares múltiplas, tiveram perdas fecais menores do que aqueles que foram realimentados com fórmulas alimentares por via oral. Assim sendo, os pacientes que foram realimentados com leite de vaca apresentaram perdas fecais médias diárias de 83,2 mL/kg de peso, fórmula à base de caseína isenta de lactose 66,4 mL/kg, fórmula à base de hidrolisado protéico e isenta de lactose 71,4 mL/kg e nutrição parenteral 50,7 mL/kg, respectivamente.
Na vigência de diarréia sanguinolenta deve-se sempre pensar em algum agente enteroinvasor, particularmente as diferentes espécies de Shigella, Salmonellaou mesmo Escherichia coli enteroinvasora. Estes microorganismos têm a capacidade de colonizar o intestino grosso e pela produção de toxinas (Shiga toxina – Shigella e Escherichia coli enteroinvasora) provocam intensa lesão no epitélio colônico gerando perdas sanguíneas fecais de moderada intensidade. Quanto às cepas de Salmonella, este microorganismo tem a propriedade de invadir as camadas mais profundas das mucosas ileal e colônica, provocando importante processo inflamatório (Figura 2).
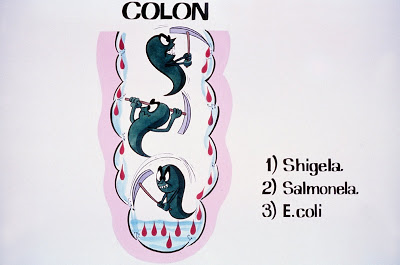
Figura 2- Desenho esquemático da ação invasora sobre a mucosa colônica dos agentes enteropatogênicos.
Fisiopatologia
A evolução de um episódio de diarréia água para persistente ocorre pelo envolvimento de múltiplos e complexos mecanismos fisiopatológicos que agravam o estado nutricional do paciente.
Dentre os inúmeros fatores que podem estar envolvidos na perpetuação do processo diarréico sem dúvida alguma ocupa lugar de destaque o sobrecrescimento bacteriano no intestino delgado pela flora colônica. Este fenômeno fisiopatológico, em particular devido às bactérias anaeróbias como Veilonella e Bacteroide, predispõe ao dano da mucosa intestinal. Estas alterações ocorrem pela capacidade das bactérias anaeróbias em provocar a desconjugação e a 7α desidroxilação dos sais biliares primários, ácido cólico e ácido quenodeoxicólico,transformando-os em seus respectivos ácidos biliares secundários, ácido deoxicólico e ácido litocólico, os quais são altamente lesivos à mucosa jejunal. Estes ácidos biliares secundários e desconjugados quando presentes na luz intestinal provocam secreção de água e sódio além de má absorção de glicose. Mais ainda, são capazes de provocar ruptura da barreira de permeabilidade intestinal favorecendo a penetração de macromoléculas intactas, potencialmente alergênicas. Além disso, a presença de sais biliares secundários e desconjugados na luz do jejuno impede a formação da micela mista, posto que a formação desta última é de fundamental importância para a solubilização das gorduras da dieta. Esta ação patológica, portanto, contribui para a ocorrência de má digestão-absorção das gorduras com consequente esteatorréia (Figuras 3 – 4 – 5 – 6 – 7 & 8).
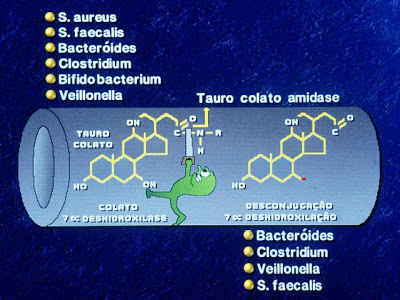
Figura 8- Descrição esquemática da 7 alfa desidroxilação de um sal biliar primário por uma bactéria anaeróbia da flora colônica.
Os ácidos graxos não absorvidos alcançam o colon aonde sofrem β-hidroxilação pela flora colônica transformando-se em substâncias catárticas que agravam o processo diarréico (Figura 9).
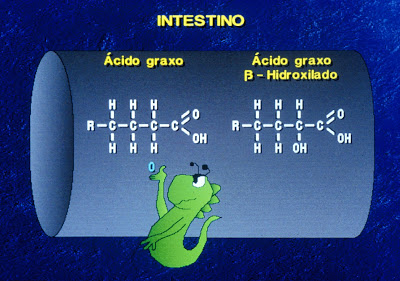
Figura 9- Descrição esquemática da beta hidroxilação de um ácido graxo por bactéria anaeróbia da flora colônica.
O resultado deste desarranjo é má absorção dos macro e micronutrientes e aumento da permeabilidade intestinal para antígenos bacterianos e/ou proteínas estranhas. Desta forma, podem se desenvolver outras complicações clínicas, tais como, alergia às proteínas da dieta e/ou intolerâncias alimentares múltiplas, em especial à lactose e até mesmo aos monossacarídeos, o que vai contribuir para a perpetuação da lesão intestinal reforçando o ciclo vicioso de diarréia, má absorção de nutrientes e desnutrição energético-protéica, que é o maior determinante do impedimento da recuperação da mucosa jejunal, além das deficiências específicas de micronutrientes.
Confirmando a hipótese acima advogada, Martini-Costa e cols., em 1999 (Rev Paul Pediatria 17:123-34), puderam caracterizar algum tipo de intolerância alimentar, ao estudar 16 pacientes de forma consecutiva e prospectiva, com grande grau de aprofundamento clínico e laboratorial, inclusive com cultura da secreção jejunal e análise ultraestrutural da mucosa do intestino delgado, as quais se manifestaram desde alergia às proteínas heterólogas, tais como do leite de vaca e da soja, intolerância à lactose e até mesmo aos monossacarídeos da dieta. Em todos os pacientes foi caracterizada colite pelo estudo da biópsia retal (Figuras 10 -11 – 12 & 13).
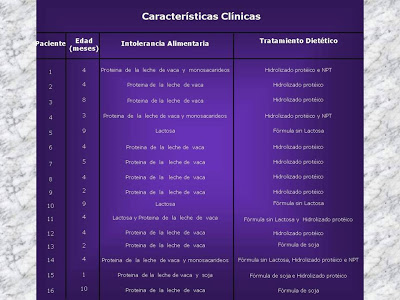
Figura 11- Vide descrição da tabela.

Figura 12- Vide descrição da tabela.

Figura 13 – Vide descrição da tabela.
Investigação Diagnóstica
Considerando que a Diarréia Persistente (DP) trata-se de uma síndrome de presumível etiologia infecciosa e que se perpetua devido a complicações de características multifatoriais, para que se possa estabelecer um diagnóstico, com precisão da etiologia e suas respectivas potenciais complicações clínicas secundárias ao processo nosológico original, devem ser obtidas detalhadas informações a respeito dos seguintes tópicos, a saber: história clínica desde o início do processo diarréico, história alimentar pregressa, existência ou não da prática do aleitamento materno, condições sócio-econômicas e de moradia, antecedentes pessoais, incluindo o histórico de episódios infecciosos anteriores, e os antecedentes familiares. O exame clínico poderá evidenciar sinais de desnutrição e a determinação do peso e da estatura irão permitir a avaliação do estado nutricional.
Com relação à investigação laboratorial deve-se sempre incluir a cultura de fezes para detectar os principais agentes enteropatogênicos bacterianos, virais e protozoários, bem como a pesquisa de ovos e parasitas em fezes recém emitidas. A investigação laboratorial deve incluir a detecção do pH fecal e a pesquisa de substâncias redutoras nas fezes, pesquisa de leucócitos e sangue oculto nas fezes, determinação da α1 anti-tripsina fecal e do esteatócrito.
Quanto à avaliação da função digestivo-absortiva, considerando-se a elevada prevalência das intolerâncias aos carboidratos da dieta descrita em pacientes com DP como fator perpetuador da diarréia, a abordagem laboratorial utilizando os testes de sobrecarga com os diversos carboidratos comumente utilizados na dieta, tais como, Lactose, Glicose e Frutose devem ser prioritariamente realizadas (Figura 1).
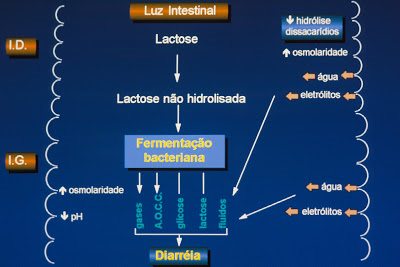
Figura 1- Representação esquemática do metabolismo da Lactose pela flora colônica quando ocorre má-absorção deste dissacarídeo.
O teste de sobrecarga com Lactulose deve também ser realizado visando à detecção de possível sobrecrescimento bacteriano no intestino delgado. Todos estes testes de sobrecarga devem preferentemente ser realizados por meio da técnica do H2 no ar expirado, posto tratar-se de um método não invasivo e com alto valor de sensibilidade e especificidade.
Princípio teórico dos testes respiratórios com Hidrogênio
No passado, acreditava-se que o pulmão fosse um órgão apenas responsável pela respiração, e, portanto, tinha-se o conceito de que somente Oxigênio (O2) e Dióxido de Carbono (CO2) pudessem ser dosados no ar expirado. Atualmente, porém, sabe-se que o ar expirado dos pulmões contém mais de 2000 substâncias distintas, e que, além da respiração, os pulmões apresentam uma função adicional, qual seja a excreção de substâncias voláteis, o que tornou os pulmões reconhecidamente como “órgãos excretores” de gases que se encontram dissolvidos no sangue. Uma destas inúmeras substâncias voláteis excretadas pelos pulmões é o Hidrogênio (H2), o qual pode ser facilmente medido com a utilização de um equipamento manual de teste respiratório.
O ser humano sadio em jejum e em repouso não elimina H2 porque o seu metabolismo não produz este gás, o qual somente é gerado durante o metabolismo anaeróbio. Considerando que o organismo humano em repouso não possui metabolismo anaeróbio, o H2 produzido e excretado pelos pulmões deve ter origem nas bactérias anaeróbias, e, como se sabe, o trato digestivo alberga um número elevado de bactérias, que são predominantemente anaeróbias e que produzem grandes quantidades de H2. Portanto, pode-se assumir, com boa margem de segurança, que o H2 expirado pelos pulmões dos seres humanos em repouso é produzido, quase que exclusivamente, pelo metabolismo bacteriano dos anaeróbios que colonizam o íleo e o intestino grosso. Desta forma, pode-se afirmar que o H2 mensurado no ar expirado diz respeito à quantidade da atividade metabólica das bactérias anaeróbias presentes no trato digestivo, em particular, em condições normais, no íleo e no intestino grosso. As bactérias anaeróbias têm preferência para metabolizar os carboidratos, os quais, como parte da reação de fermentação, são “quebrados” dando a formação de ácidos graxos de cadeia pequena, CO2 e H2 (Figura 1). Uma grande parte do CO2 permanece na luz do intestino e é responsável pela sensação de flatulência, enquanto que os ácidos graxos de cadeia pequena exercem efeito osmótico atraindo água para o interior do lúmen intestinal, causando diarréia. O H2 produzido no intestino atravessa a parede intestinal, cai na circulação sanguínea, é transportado até os pulmões e, finalmente, é eliminado pela respiração como parte do ar expirado, podendo, portanto, ser facilmente mensurado. A concentração do H2 mensurado na expiração é sempre um reflexo da massa de bactérias e da atividade metabólica bacteriana no trato digestivo. O momento no qual a concentração de H2 no ar expirado se eleva durante a realização do teste respiratório fornece a indicação em qual região do intestino se deu a fermentação.
Normas para a realização do teste do H2 no ar expirado
Cada teste deve sempre se iniciar obtendo-se a amostra de jejum para a mensuração do H2 no ar expirado. Vale ressaltar que o paciente deve estar em jejum pelo período de ao menos 8 horas. Após a mensuração do valor basal de jejum que deve na imensa maioria dos casos ser inferior a 5 partes por milhão (ppm) o teste respiratório pode começar. O paciente deve ingerir o conteúdo de uma solução aquosa diluída a 10% do carboidrato que se deseja testar a tolerância e/ou absorção à dose de 2 gramas/kg de peso para os dissacarídeos e à dose de 1 grama/kg de peso para os monossacarídeos. A dose máxima do carboidrato a ser testado não deve ultrapassar 25 gramas. Após a obtenção da amostra de jejum e da ingestão da solução aquosa contendo o carboidrato a ser testado amostras de ar expirado devem ser obtidas aos 15, 30, 60, 90 e 120 minutos. Caso o teste seja realizado comLactulose (a dose é fixa de 20 gramas diluída a 10% em água), para pesquisa deSobrecrescimento Bacteriano no Intestino Delgado, deve-se acrescentar uma coleta de amostra do ar expirado aos 45 minutos após a amostra de jejum. Vale salientar que a Lactulose é um dissacarídeo sintético (frutose-galactose) não absorvível que exerce efeito osmótico e, portanto, pode provocar sintomas após sua ingestão, tais como, flatulência, cólicas e diarréia, os quais costumam desaparecer pouco tempo depois do término do teste.
Interpretação do Teste do H2 no ar expirado
1- Teste Normal
No caso de haver suficiência de Lactase, não deverá ocorrer aumento significativo da concentração de H2 no ar expirado (elevação inferior a 20 ppm sobre o nível de jejum) e nem tampouco referência a manifestações clínicas. Desta forma o teste deve ser considerado Normal (Figura 2).
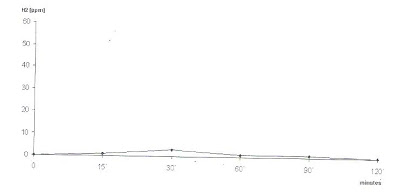
Figura 2- Teste de Sobrecarga com Lactose: não houve elevação da concentração do H2 no ar expirado após a sobrecarga em nenhum momento do teste.
Caso surjam sintomas clínicos e a concentração de H2 no ar expirado for inferior a 20 ppm, trata-se de um não produtor de H2, o que pode ocorrer em até 5% dos indivíduos testados. Nesta circunstância para se estabelecer um diagnóstico de segurança deve ser realizado o teste com Lactulose, posto que este dissacarídeo é sempre fermentado, e, se ainda assim não houver elevação da concentração de H2 no ar expirado pode-se assumir com segurança tratar-se de um não produtor deH2.
2- Teste Anormal
Uma elevação da concentração de H2 acima de 20 ppm sobre o nível de jejum é considerado um teste Anormal (Figura 3).
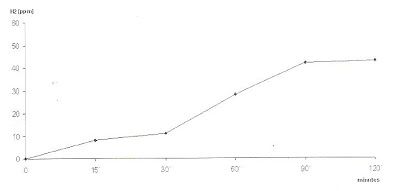
Figura 3- Teste anormal de sobrecarga com Lactose: elevação tardia (fermentação colônica) da concentração do H2 no ar expirado acima de 20 ppm sobre o valor de jejum.
Além disso, um outro fator também deve ser levado em consideração, pois se houver uma elevação da concentração de H2 acima de 10 ppm sobre o nível de jejum dentro dos primeiros 30 minutos do teste, este valor é indicativo de Sobrecrescimento Bacteriano no Intestino Delgado (Figura 4).
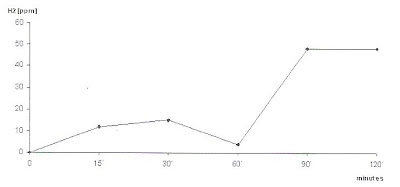
Figura 4- Teste anormal de sobrecarga com Lactose: pico precoce (antes dos 60 minutos indicando Sobrecrescimento Bacteriano) e pico tardio concentração do H2 no ar expirado acima de 20 ppm sobre o nível de jejum (fermentação colônica).
Biópsia de Intestino Delgado e Reto
Para complementar a investigação laboratorial, em muitos casos, está indicada a realização da biópsia do intestino delgado para avaliação anátomo-patológica da mucosa jejunal (Figuras 5 – 6 & 7).
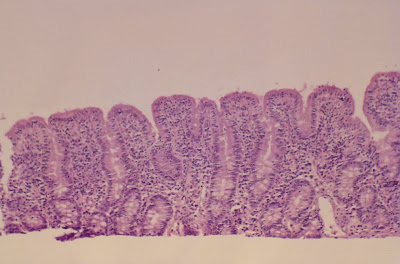
Figura 5- Material de biópsia de intestino delgado evidenciando atrofia vilositária sub-total e intenso infiltrado linfo-plasmocitário na lâmina própria.
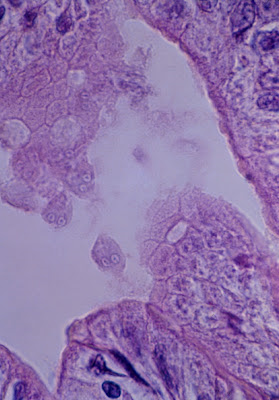
Figura 6- Material de biópsia de intestino delgado evidenciando vários trofozoítas de Giardia na luz do jejuno próximos aos enterócitos.
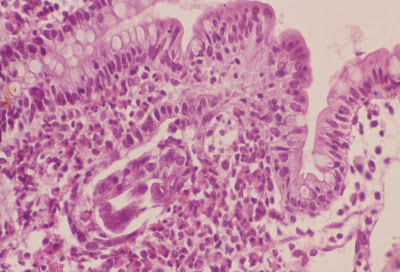
Figura 7- Material de biópsia de intestino delgado evidenciando a presença de uma larva de Strongiloides stercoralis no interior da lâmina própria.
A biópsia retal está indicada quando houver diarréia sanguinolenta para avaliar o grau e o tipo do possível processo inflamatório vigente (Figuras 8 & 9).
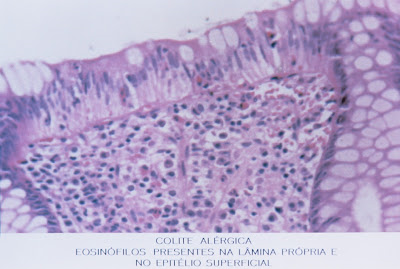
Figura 8- Vide legenda da foto.
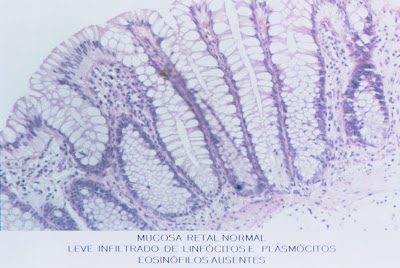
Figura 9- Vide legenda da foto.
Manejo Terapêutico
A Organização Mundial da Saúde, em um relatório publicado em 2009,estima que morrem anualmente cerca de 9.000.000 de crianças, com menos de 5 anos de idade, a cada ano em todo o nosso universo. A doença diarréica é a segunda causa mais importante de morte com 16%, logo a seguir da pneumonia com 17% das mortes, excluindo as diversas causas neonatais que são responsáveis por 37% delas. A pergunta que se impõe é por que uma enfermidade de fácil prevenção causa a morte de cerca de 1.500.000 de crianças menores de 5 anos de idade? A redução destes índices de mortalidade depende, por um lado, da intervenção terapêutica tornando universal a distribuição da solução de reidratação oral de baixa osmolaridade e da prescrição de Zinco. Por outro lado, medidas preventivas também são necessárias serem implementadas as quais serão posteriormente abordadas.
Do ponto de vista do manejo terapêutico está bem estabelecida a importância da reidratação oral (considerada um dos maiores avanços terapêuticos da Medicina do século XX) e da conduta dietética adequada na fase aguda da diarréia para evitar seu prolongamento. É importante ressaltar que a suspensão prolongada da dieta contribui diretamente para o agravamento do estado nutricional, pois dificulta o reparo da mucosa intestinal, enquanto que o uso abusivo e indiscriminado de antimicrobianos altera a microbiota, o que vem a contribuir para a persistência da diarréia, e, portanto, agravando a evolução do episódio.
Na nossa experiência clínica, consolidada no atendimento de crianças portadoras de DP na Unidade Metabólica “Horácio Toccalino” do Hospital Umberto I, durante toda uma década, nos anos 1980 e 1990, passamos a definir como fatores de risco para má evolução do processo diarréico, a ocorrência em lactentes menores de seis meses de idade ou menores de um ano com desnutrição grave, a presença de desidratação e/ou distúrbios metabólicos, o prolongamento do quadro diarréico com importante agravo do estado nutricional ou freqüentes recidivas de desidratação e/ou acidose (Figuras 1 & 2).
Na vigência desta condição clínica a conduta indicada é realimentar o paciente com fórmula à base de proteínas hidrolisadas extensivamente hidrolisadas, ou mesmo, caso necessário, fórmula à base de mistura de amino-ácidos. Nos casos de anorexia persistente, utilizar alimentação por sonda nasogástrica ou se possível naso-enteral, preferencialmente em gotejamento contínuo, sempre preconizando transição para dieta por via oral o mais rapidamente possível. Caso não se obtenha sucesso, indicar o uso de nutrição parenteral (preferentemente por via periférica para diminuir os riscos de infecção sistêmica devido à contaminação do cateter), sempre objetivando o retorno à dieta por via oral o mais rapidamente possível (Figuras 3).
Diante da gravidade da diarréia, a qual ainda é considerada um importante problema de saúde pública, e que depende da integridade do sistema imunológico para ser solucionada, Rocha e cols., em 2009 (The Electronic J Ped Gastroenterol Nutr), em estudo de metanálise, confirmaram o importante impacto positivo da prescrição de Zinco e da vitamina A sobre a imunidade celular, auxiliando no tratamento da diarréia aguda e persistente. Os autores concluíram que a prescrição de Zinco é não somente essencial como elemento curativo dos episódios de diarréia mas também desempenha especial papel de caráter preventivo contra esta patologia. Para alcançar este objetivo, é necessário que se faça a suplementação diária de Zinco, à dose de 10 mg/dia, por um período de 2 a 3 meses após cessar o episódio de diarréia, e a ingestão permanentemente adequada de fontes alimentares para que seja possível atingir as recomendações de ingestão diária deste micronutriente. Lucacik e cols., em 2008 (Pediatr 121:326-36), comprovaram a eficácia desta conduta no manejo da DP e sugerem que este efeito ocorre pelo aumento da reabsorção de água e eletrólitos pelo intestino e pelo aumento da capacidade de regeneração do epitélio intestinal. Níveis aumentados das dissacaridases na bordadura em escova dos enterócitos indicam um efeito transportador para este eletrólito e uma forte resposta imune auxiliando na defesa intestinal, a qual também tem sido descrita quando o Zinco encontra-se em níveis plasmáticos adequados (Figuras 4 -5 – 6 & 7).
Com relação aos antimicrobianos em pacientes com DP, em algumas circunstâncias existem evidências que seu uso pode diminuir o tempo de duração dos sintomas e em alguns casos diminuir a probabilidade de transmissão da doença. No entanto, sabendo-se que o isolamento de enteropatógenos nas fezes de crianças predispostas a este tipo de patologia não é maior do que nos controles e que a relação do patógeno isolado com o processo vigente é discutível, o emprego de antimicrobianos não é recomendado como rotina. Indica-se antibioticoterapia quando há comprovação bem estabelecida nos casos de infecção prolongada porSalmonella, Giardia, Cyclospora, Strongyloides e Escherichia coli enteroagregativa (neste último caso especialmente se a criança for menor de 3 meses de vida ou desnutrida, imunodeprimida ou apresentar sinais de doença invasiva). Na presença de sangue nas fezes está indicada antibioticoterapia nos casos comprovados de infecção por Shigella e Entamoeba hystolitica, ou seja, quando o patógeno é isolado nas fezes. A decisão de prescrever antibióticos deve ser considerada, portanto, à comprovação laboratorial do agente enteropatogênico nas fezes e ao tipo de resistência microbiana.
Profilaxia
No relatório apresentado pela Organização Mundial da Saúde de 2009, são propostas, além das 2 medidas terapêuticas acima mencionadas, para o controle da doença diarréica, 5 medidas preventivas, a saber: 1- vacinação contra o Rotavirus e o Sarampo; 2- promoção do aleitamento natural exclusivo e suplementação com vitamina A; 3- promoção da lavagem das mãos com sabão; 4- melhoria em qualidade e quantidade do suprimento de água, incluindo o tratamento da água estocada em casa; 5- universalização do saneamento básico.
As intervenções indicadas para diminuição da incidência da DP incluem aleitamento materno exclusivo e prolongado e estratégias seguras de alimentação para garantir adequado desenvolvimento pondero-estatural considerando-se que a desnutrição protéico-calórica é fator de risco para esta síndrome. Durante o episódio agudo são necessárias medidas para garantir a hidratação, suplementação de Zinco e a não interrupção da alimentação. Quando o episódio agudo se prolonga além de 7 dias, está-se frente ao que se denomina diarréia prolongada (Pro-D, com duração entre 7 e 13 dias), cuja epidemiologia ainda tem sido pouco estudada. Recentemente, no nordeste do Brasil (Fortaleza/Ceará), Moore e cols., em 2010 (Gastroenterology 139:1156-64), demonstraram que crianças que apresentam episódios prolongados de diarréia apresentam 2,2 vezes maior probabilidade de desenvolverem DP na sua infância tardia. Este risco aumentado ocorre pelo efeito da patologia sobre o estado nutricional, o sistema imunológico e pela indução de alterações na barreira intestinal ou alterações da flora intestinal.
No Brasil, várias medidas de caráter universal e que se tornaram consistentes desde o início dos anos 1990, tais como campanhas bem sucedidas de promoção da terapia de reidratação oral, a criação e consolidação do Sistema Único de Saúde, e, em particular a implantação do Programa de Saúde da Família, em 1994, possibilitaram alcançar uma considerável diminuição nas taxas de mortalidade associadas à diarréia nas crianças menores de 5 anos de idade.
Assim termino este fascinante capítulo da minha especialidade e logo mais iniciarei mais um excitante e importante tema, qual seja as manifestações digestivas causadas pela Síndrome da Imnodeficiência Adquirida (Sida) ou AIDS sigla em inglês que se consagrou em nosso meio da Syndrome of the Acquired Immune Deficiency.
Aproveito também o momento para agradecer aos meus leitores espalhados em mais 70 países do globo terrestre pela confiança em mim depositada e pelas palavras de apoio e estímulo. Desejo a todos vocês um Feliz Natal e um Ano Novo repleto de realizações com muita paz, saúde e amor. Que seus mais almejados e longínquos sonhos se transformem em doce realidade são os meus mais sinceros desejos.