Um Consenso Global Baseado em Evidências a respeito da Definição da Doença do Refluxo Esofágico na população Pediátrica
Atenção! As imagens e tabelas que possam ter sido referenciadas no texto estão em processo de atualização! Em breve você acessará uma versão atualizada deste artigo.
Nestes próximos contatos irei publicar a íntegra do trabalho, em capítulos, que foi publicado no American Journal of Gastroenterology 2009; 104: 1278-95, vertido para o português, a respeito de um consenso global sobre a definição da Doença do Refluxo Gastro-Esofágico. Este mesmo trabalho devido sua enorme importância clínica já foi vertido para o alemão na revista Elektronischer Sonderdruck fur 2010; 158:164-76, e para o francês na revista Archives de Pédiatrie 2010; 17: 1586-93. Em português etá publicado no http://www.e-gastroped.com.br/mar11/consenso_inter.htm. Este consenso se desenvolveu durante o ano de 2007 com a participação de 9 Gastroenterologistas Pediátricos de reconhecido prestigio internacional, por meio de várias reuniões virtuais e 2 presenciais, a primeira em setembro em Toronto, Canadá, e a segunda em dezembro em Londres, Inglaterra. Segue abaixo o manuscrito vertido para o português:
Um Consenso Global Baseado em Evidências a respeito da Definição da Doença do Refluxo Esofágico na população PediátricaPhilip M. Sherman, MD1, Eric Hassall, MD2, Ulysses Fagundes-Neto, MD3, Benjamin D. Gold, MD4, Seiichi Kato, MD5, Sibylle Koletzko, MD6, Susan Orenstein, MD7, Colin Rudolph, MD8, Nimish Vakil M, D9, 10, Yvan Vandenplas, MD11
1- Gastroenterology-Pediatric, Hospital for Sick Children, University of Toronto, Toronto, Canadá; 2- Division of Gastroenterology, British Columbia Children’s Hospital/University of British Columbia, Vancouver, Canadá; 3- Disciplina de Gastroenterologia, Departamento de Pediatria, Escola Paulista de Medicina, Universidade Federal de São Paulo, São Paulo, Brasil; 4- Division of Pediatric Gastroenterology, Hepatology and Nutrition, Emory University School of Medicine, Atlanta, Georgia,USA; 5- Department of Pediatrics, Tohoku University School of Medicine, Sendai, Japan; 6- Dr von Haunersches Kinderspital, Ludwig Maximilians University, Munich, Germany ; 7- University of Pittsburgh School of Medicine, Pittsburgh, Pennsylvania, USA; 8- Division of Pediatric Gastroenterology and Nutrition, Medical College of Wisconsin, Milwaukee, Wisconsin, USA; 9- University of Wisconsin School of Medicine and Public Health, Madison, Wisconsin, USA; 10- Marquette University College of Health Science, Milwaukee, Wisconsin, USA; 11- Department of Pediatrics, UZ Brussel Kinderen, Vrije Universiteit Brussel, Brussels, Belgium .
Correspondência: Ulysses Fagundes Neto, Disciplina de Gastroenterologia, Departamento de Pediatria, Escola Paulista de Medicina, Universidade Federal de São Paulo
e-mail: [email protected]
RESUMO
OBJETIVOS: Desenvolver um consenso internacional para a definição da doença do refluxo gastro-esofágico (DRGE) na população pediátrica.
MÉTODOS: A partir do uso do processo de Delphi, um conjunto de afirmações foi desenvolvido e votado por um grupo internacional de oito gastroenterologistas pediatras. As afirmações foram baseadas em pesquisas sistemáticas da literatura usando as seguintes bases de dados: Medline, EMBASE e CINAHL. A votação foi realizada utilizando uma escala de seis pontos, com o consenso definido a priori, quando houve um acordo de pelo menos 75% entre os membros do grupo. A força de cada afirmação foi avaliada usando o sistema GRADE.
RESULTADOS: Houve quatro rodadas de votação. Na votação final, foi obtido consenso em 98% das 59 afirmações. Nesta votação, 95% delas foram aceitas por sete dos oito votantes. Itens de consenso de particular importância foram: (i) a DRGE está presente quando o material refluído do conteúdo gástrico provoca sintomas e/ou complicações, mas esta definição é dificultada pela falta de uma comunicação confiável dos sintomas em crianças com idade inferior a 8 anos. (ii) a histologia tem limitado uso no estabelecimento ou na exclusão do diagnóstico da DRGE. Seu papel principal é a exclusão de outras condições. (iii) esôfago de Barrett deve ser definido como uma metaplasia esofágica, a qual se trata de uma metaplasia intestinal, positiva ou negativa; e (iv) manifestações extraesofágicas podem estar associadas com a DRGE, mas, para a maioria destas condições a causalidade necessita ser comprovada.
CONCLUSÕES: As afirmações do Consenso que compreendem a Definição da DRGE na população pediátrica foram desenvolvidas através de um processo rigoroso. Estas afirmações destinam-se a ser usadas para o desenvolvimento de normas de conduta para a prática clínica e para servir de base para ensaios clínicos.
Introdução
A definição de Montreal da Doença do Refluxo Gastro-Esofágico (DRGE) foi desenvolvida como um documento de consenso internacional com base em evidências e revisões de trabalhos que foram realizados em adultos e publicados em revistas indexadas (1). Estas diretrizes estão sendo atualmente usadas para definir as prioridades de pesquisas e como base para orientações para o manejo dos pacientes, em muitas partes do mundo. Ainda que o trabalho deste grupo tivesse sido limitado aos adultos, foi feita a ressalva de que há o devido reconhecimento da existência de necessidades específicas na abordagem do problema na população pediátrica (1).
Uma vasta gama de profissionais da saúde maneja a DRGE na faixa etária pediátrica, a qual compreende recém-nascidos, lactentes, crianças pré-escolares, crianças escolares e adolescentes. Uma recente pesquisa sobre os conhecimentos, atitudes e estilos de prática dos profissionais de saúde em Pediatria, tais como pediatras gerais e sub-especialistas, constatou que existe uma grande variedade de definições para a DRGE sendo empregada na literatura e na prática diária (2). Esta variedade de condições clínicas e nomenclaturas inconsistentes contribuem para as diversidades nas abordagens clínicas dos pacientes. Além disso, a falta de definições claras para a DRGE e suas manifestações em lactentes, crianças e adolescentes causa uma significativa confusão para o clínico, tanto ao interpretar os dados da literatura como para tentar entender o emprego dos testes diagnósticos atualmente disponíveis. Por todos estes motivos, existe, então, a necessidade de se estabelecer uma definição uniforme para a DRGE que possa vir a ser usada nestas diferentes faixas etárias pediátricas.
Uma ação colaborativa, das sociedades européia e norte-americana de gastroenterologia pediátrica, hepatologia e nutrição, enfatizou a necessidade de serem desenvolvidos critérios internacionalmente aceitos, e também, de apoiar as recomendações obtidas a partir de uma revisão sistemática da literatura, com vistas à atualização a respeito das orientações sobre o manejo da DRGE (3). A definição de Montreal para a DRGE e o processo usado para desenvolvê-la criou um quadro conceitual que serviu de base para fundamentar o presente trabalho sobre a DRGE na Pediatria. Isto posto, nosso objetivo foi desenvolver um consenso internacional sobre a definição e classificação da DRGE. Vale a pena referir que o presente esforço difere de outras publicações cujo escopo versa a respeito de recomendações sobre o manejo na DRGE. As afirmações geradas do presente consenso destinam-se ao futuro desenvolvimento de normas para a prática clínica e para ensaios clínicos, que possam incluir pacientes portadores da DRGE e controles, bem como respaldar a melhor conduta terapêutica em pacientes pediátricos com a DRGE.
Métodos
Uma técnica Delphi modificada, análoga a utilizada no desenvolvimento da definição de Montreal para a DRGE em adultos (1), foi utilizada para desenvolver as afirmações concernentes à definição da DRGE na população pediátrica. As principais etapas deste processo foram as seguintes: (i) seleção de um grupo internacional para trabalhar no consenso (ii) desenvolvimento do esboço das afirmações (iii) análise sistemática da literatura para identificar e avaliar criticamente as evidências relevantes para cada uma das afirmações, e, (iv) voto anônimo, discussão e votação anônima repetida, pelo grupo de consenso, sobre uma série de iterações de cada uma das afirmações do esboço inicial. Um gastroenterologista de adultos sem direito a voto (NV) que havia sido o presidente do Comitê do Consenso de Montreal explanou como se deu a elaboração do referido consenso, bem como salientou os aspectos mais relevantes daquele evento. Além disso, ele revisou materiais para as afirmações e forneceu os meios de acesso para as revisões da literatura. Os membros do grupo concordaram que era preferível aplicar definições de adultos (1), sempre que pertinentes, de forma a evitar confusões sobre terminologias que poderiam se tornar conflitantes. No entanto, reconheceu-se que as diferenças entre os pacientes pediátricos e adultos, e, dentro do próprio grupo de idade pediátrico propriamente dito (lactentes, crianças e adolescentes), tornaram necessárias que as definições fossem especificadas para cada grupo etário. Nesse sentido, para efeito prático, foram consensuados arbitrariamente, três grupos de idade, a saber: recém-nascidos e lactentes (0-12 meses), crianças pré-escolares e escolares (1 – 10 anos), e adolescentes (11-18 anos).
Seleção do grupo de consenso
Um Presidente sem direito a voto (PS) liderou o grupo de consenso. Membros do grupo foram selecionados pelo Presidente, com base nos seguintes critérios: experiência reconhecida sobre a DRGE em Pediatria, evidenciada por publicações relevantes em periódicos indexados, atividades de investigação, participação em eventos nacionais ou regionais e experiência no desenvolvimento de normas para práticas clínicas. A escolha do grupo de consenso foi também influenciada pela necessidade de haver uma representatividade internacional e pela diversidade de opiniões e conhecimentos no campo.
Pesquisa sistemática da literatura biomédica
De Janeiro de 1980 a Dezembro de 2007, estudos relevantes publicados em língua inglesa em seres humanos foram identificados através de pesquisas sistemáticas no Medline, EMBASE e CINAHL. O Presidente disponibilizou vários meios de busca (disponíveis mediante solicitação), revisou os resultados da pesquisa e selecionou artigos para uma posterior revisão. Membros do grupo também contribuíram com pesquisas adicionais da literatura. Os artigos foram acrescentados durante a evolução dos trabalhos e distribuídos a todos os membros do grupo de consenso.
Graus de Evidência (Notas de prova)
O poder da evidência (prova) foi avaliado utilizando o sistema GRADE (4), cuja classificação se dá da seguinte forma: Alta: é improvável que alguma investigação adicional altere nossa confiança na estimativa do efeito. Moderada: investigação adicional provavelmente terá um impacto importante na nossa confiança na estimativa do efeito e pode mudar a estimativa. Baixo: É muito provável que investigação adicional tenha um impacto importante na nossa confiança na estimativa do efeito podendo mudá-la. Muito baixa: qualquer estimativa do efeito é incerta.
A designação “não aplicável” foi empregada para situações em que estes graus de evidência não foram relevantes para uma afirmação específica. Um grau preliminar de evidência foi atribuído para cada afirmação antes da iteração final. Cada afirmação foi examinada por todos os membros do grupo de consenso após a votação final e novamente nos rascunhos do manuscrito.
Votos nas afirmações do consenso:
O grupo votou nas quatro iterações em cada uma das afirmações do consenso. Entre cada uma das quatro votações as afirmações foram revistas levando-se em consideração o feedback (retorno) do grupo, a opinião de especialistas externos (um médico de família, uma pediatra geral acadêmica, um neonatologista, um pneumologista pediátrico, otorrinolaringologistas pediátricos e cirurgiões gerais pediátricos) e, ainda, mais uma revisão crítica da literatura disponível. Afirmações adicionais foram acrescidas nos tópicos específicos da Pediatria, e que não haviam sido abordados anteriormente, particularmente aquelas condições que apresentam sinais e/ou sintomas que são semelhantes ou poderiam ser confundidos com a DRGE, tais como alergia alimentar. A votação final foi realizada num encontro presencial que ocorreu com tempo para ampla discussão. A votação foi anônima, conduzida usando “touch pads” eletrônicos e as porcentagens das votações foram projetadas em uma tela depois de cada votação. Foi utilizada uma escala de seis pontos: (I) concordo fortemente (A+), (II) concordo moderadamente (A), (III) apenas concordo (A−), (IV) apenas discordo (−D), (V) discordo moderadamente (D) e (VI) discordo veementemente (D+).
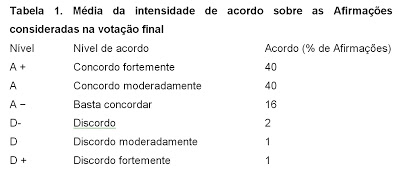
Foi definido, a priori, como consenso quando houve concordância para a respectiva afirmação (a soma das votações para A +, A ou A-) por pelo menos três quartos (ou seja, ≥75%) dos membros votantes. O nível de acordo na votação final que foi dado para cada afirmação, expresso em percentagem, está especificado na Tabela 1.
Fontes de financiamento e organização das oficinas de trabalho
Duas oficinas de trabalho presenciais foram organizadas e financiadas por terceiros, (INSINC Consulting (Guelph, ON)), por meio de uma bolsa irrestrita da Astra Zeneca Research and Development (Mölndal, Suécia). A Astra Zeneca não teve participação sobre o conteúdo e a conduta das oficinas de trabalho, nem na elaboração das afirmações deste documento. Dra. Catherine Henderson (Oxford PharmaGenesis Ltd, Oxford, Reino Unido) gerenciou o banco de dados da literatura, preparado minutos antes das reuniões presenciais e incorporou os comentários escritos elaborados por cada membro do grupo de consenso em um único documento, que ela reeditou. Deste documento, o Presidente preparou um primeiro resumo, que foi revisado através de várias iterações por um membro do grupo de consenso (EH), com a participação de todos os membros do grupo de consenso. O Presidente e os membros do grupo de consenso elaboraram o conteúdo do documento final, pelo qual eles são total e unicamente responsáveis.
Divulgações de potencial conflito de interesse dos membros da Comissão foram documentadas antes da primeira reunião do Comitê e distribuídas a todos os membros. Semelhante ao processo de Montreal, o objetivo do empreendimento foi essencialmente o de estabelecer as definições da DRGE, e não advogar a favor ou contra qualquer tratamento ou teste diagnóstico (5). Os principais pontos emergentes desta iniciativa foram apresentados em um poster no fórum de um simpósio no III Congresso Mundial de Gastroenterologia Pediátrica Hepatologia e Nutrição, realizado na Foz do Iguaçu, Brasil, em agosto de 2008.
RESULTADOS
Visão geral sobre as votações
Para a primeira votação, foram apresentadas 62 afirmações, com base nas 50 afirmações da definição de Montreal (1) e em 12 afirmações adicionais com particular relevância para a população pediátrica, conforme proposto pela Presidência. Foi alcançado consenso sobre 47 (76%) das 62 afirmações apresentadas na primeira votação. Para a segunda votação, o número de afirmações aumentou substancialmente para 117, principalmente por causa da decisão do grupo de votar em muitas das afirmações separadamente para cada um dos três grupos de idade pediátricos (recém-nascidos e lactentes, crianças e adolescentes). Consenso foi alcançado em 78 das 117 afirmações (67%).
Para a terceira rodada de votação, foram consideradas 86 afirmações, com o grupo chegando a um consenso em 57 (66%) delas. Na votação final, houve 59 afirmações, tendo ocorrido consenso em 98% (58) delas, e uma concordância por mais de 87% do grupo votante foi alcançado em 95% (56) delas. A força de concordância na votação final está especificada na tabela 1.
UMA DEFINIÇÃO GLOBAL DA DRGE NA POPULAÇÃO PEDIÁTRICA:
1. DRGE em pacientes pediátricos está presente quando o refluxo do conteúdo gástrico é a causa dos sintomas incômodos e/ou de complicações.
Concordância: 100% (A+, 87,5%; A, 12,5%. Grau de evidência: não aplicável).
A abordagem, adotada na Definição de Montreal para a DRGE em adultos, foi baseada na definição dos sintomas descritos pelos pacientes na medida em que o refluxo começava a provocar problemas com impacto mensurável sobre a qualidade de vida do paciente (1). Esta abordagem também se aplica às crianças, mas com várias advertências. O desenvolvimento das crianças e suas habilidades comunicativas são impositivos para uma abordagem no sentido de estabelecer definições específicas para cada grupo etário. Nas crianças, a definição de quando os sintomas se tornam incômodos — e quem define que os sintomas são incômodos — é de mais difícil confiabilidade por diversos fatores. Embora a criança que já aprendeu a se expressar verbalmente possa comunicar a dor, descrições da intensidade, localização e gravidade, das mesmas, podem não ser confiáveis até pelo menos os 8 anos de idade e às vezes até mais tarde (6,7).
As crianças pré-escolares são geralmente mais sugestionáveis. Consultas aos pais ou cuidadores sobre um sintoma específico são geralmente feitas para obter respostas do tipo SIM ou Não, o que pode diminuir, assim, a confiabilidade do sintoma relatado pela criança com suspeita da DRGE. Assim sendo, para se poder levar em consideração de forma confiável a queixa de um sintoma incômodo para firmar o diagnóstico da DRGE a criança deve ter mais de 8 anos de idade. Em pacientes mais jovens, a confiabilidade nos pais ou cuidadores é geralmente necessária, mas o relato dos sintomas por substitutos (pais ou cuidadores) pode diminuir a validade do diagnóstico. Portanto, a questão do que é “incômodo” é mais complicada na faixa etária pediátrica do que nos adultos. O FDA americano (Food and Drug Administration) recomenda que o relato do paciente forme a base dos ensaios clínicos (http://www.fda.gov/cder/guidance/5460dF. htm).
Dadas as limitações dos relatos das crianças que são menores de 8 anos, a informação do paciente deve ser complementada ou substituída por relatos dos pais ou cuidadores. Questionários adaptados para cada faixa etária são necessários para se alcançar a confiabilidade, bem como a avaliação e o diagnóstico do referido sintoma na Pediatria (8,9).
2. Sintomas da DRGE variam com a idade.
Concordância: 100% (A+, 87,5%; A−, 12,5%; Grau: Alto).
Em adultos, pirose e regurgitação são sintomas característicos da DRGE (1). O mesmo ocorre nas crianças escolares e adolescentes (10,11). Nos lactentes e crianças pré-escolares é mais complicado. Durante a validação do escore para o diagnóstico da DRGE, diferenças significativas foram identificadas na prevalência de regurgitação, recusa alimentar e choro entre uma coorte de lactentes saudáveis com estudos de pHmetria esofágica anormal e/ou biópsias anormais (12). No entanto, a falta de resposta destes sintomas à terapia com inibidor da bomba de prótons (IBP) contrasta com suas respostas à terapia com agentes não-farmacológicos, o que levanta questionamentos sobre a eficácia da medicação antiácida para estes sintomas, e se no caso da medicação ainda estiver vigente, permanece a dúvida se estes episódios seriam mesmo de refluxo ácido (13,14). Nesse sentido, o diagnóstico com base nos sintomas da DRGE em lactentes continua a ser um problema.
Em um estudo envolvendo crianças de 1 a 17 anos de idade, tosse, anorexia/ recusa alimentar e regurgitação/vômito foram mais graves em crianças que tinham entre 1 e 5 anos de idade, em comparação com os sintomas presentes nas crianças de maior idade (10). Neste estudo, lactentes e crianças pré-escolares (1–6 anos) tendiam a apresentar recusa alimentar, regurgitação e dor abdominal. Em contraste, nas crianças maiores (6-17 anos) os sintomas predominantes são regurgitação ou vômito, tosse e dor epigástrica ou pirose (10,15).
Quanto maior a criança, mais a pirose e a regurgitação tornam-se predominantes (10,11). Em geral, de 1 a 11 anos de idade, há relativamente poucos dados sobre sintomas de apresentação e não há definições padronizadas nos estudos realizados (10). Por exemplo, alguns estudos permitem a inclusão de dor abdominal, dor epigástrica ou ambos (10,15,16). A variabilidade dos sintomas e sinais da DRGE nos grupos etários pediátricos exige maior desenvolvimento de definições com base na idade, padrão-ouro e a validação de questionários baseados nos sintomas.
3. Sintomas devido à DRGE são incômodos quando eles apresentam efeitos adversos sobre a qualidade de vida do paciente pediátrico.
Concordância: 100% (A+, 12,5%; A, 75%; A−, 12,5%; Grau: não aplicável).
4. Para os recém-nascidos saudáveis e (idade: 1–28 dias) e lactentes (idade: >28 dias a <1 ano) com sintomas de refluxo e que não apresentam complicações não devem ser diagnosticadas como DRGE.
Concordância: 87,5% (A+, 62,5%; A, 12,5%; A−, 12,5%; D−, 12,5%; Grau: não aplicável).
5. Sintomas de refluxo que não são incômodos em lactentes e crianças (idade: 1–10 anos) não devem ser diagnosticados como DRGE.
Concordância: 75% (A+, 37,5%; A, 37,5%; D−, 12,5%; D, 12,5%; Grau: não aplicável).
6. Sintomas de refluxo que não são incômodos em adolescentes (idade: 11-18 anos) não devem ser diagnosticados como DRGE.
Concordância: 87.5% (A+, 50%; A, 37,5%; D−, 12,5%; Grau: não aplicável).
Quanto à afirmação 4, até 70% dos recém-nascidos saudáveis e lactentes apresentam regurgitação e este sintoma é considerado fisiológico, o qual desaparece sem intervenções em 95% dos indivíduos até os 12 a 14 meses de idade (17-19). Em um estudo baseado em questionário, aplicado em lactentes saudáveis atendidos em visitas de rotina (17), regurgitação diária atingiu um pico de 67% nas crianças de até 4 meses de idade e diminuiu para 21% nas crianças até os 7 meses de idade e 5% entre 10 e 12 meses. Regurgitação no subgrupo das crianças mais afetadas — aquelas com regurgitações mais freqüentes (mais de quatro episódios diários) — atingiu o pico em uma idade semelhante e desapareceu da mesma forma. Regurgitação descrita como “um problema” (possivelmente semelhante a “incômodo”) pela mãe apareceu aos 6 meses em 23% e diminuiu para 14% aos 7 meses de idade. Choro é também comum em recém-nascidos não selecionados; a média diária de duração do choro no segundo mês de vida é em torno de 2 a 2,5 horas, diminuindo posteriormente (20). Entre as crianças de 1 a 3 meses de idade, a duração média do choro é de 3 horas por dia (mediana: <1,5 horas por dia), o que sugere que existe um subgrupo que apresenta choro prolongado. De 4 a 12 meses de idade, a duração do choro permanece relativamente constante, na média de 1hora por dia (mediana: aproximadamente 0,5 hora). Com respeito ao subgrupo dos lactentes não selecionados com histórico de choro prolongado por mais de 3 horas ao dia, isto ocorreu em 29% dos recém-nascidos durante os primeiros 3 meses de vida, mas houve uma diminuição do mesmo, passando a vigorar em <10% das crianças de 3 a 12 meses de idade (21). O mesmo estudo a respeito do choro revelou que 11% das mães procuraram o pediatra nos 3 primeiros meses de vida, e, menos de 4% delas nos meses restantes do primeiro ano de vida. A questão do choro inexplicado é complicada e também deve ser avaliada de acordo com os modelos de choro e pela forma como o choro é percebido pelos pais (21). Consequentemente, em lactentes, regurgitação e choro “normal” ou “anormal” decorrente de outra causa que não a DRGE podem ser confundidos com a DRGE (22,23).
Os dados disponíveis a respeito da prevalência dos sintomas de refluxo que deveriam ser classificados como “incômodos” na infância são limitados. Sugestões de limiares quantitativos disponíveis em base de dados para regurgitação “incômoda” e choro foram descritos acima, mas estes dados apresentam baixas sensibilidade e especificidade. Além disso, “incômodo” é um conceito subjetivo. Outros dados sugerem que a combinação de parâmetros quantitativos dos sintomas com o conjunto de diferentes sintomas pode melhor definir o conceito de “incômodo” e, assim, ajudar a distinguir a DRGE do RGE (12). Conforme relatado por Nelson e cols. (17), “A percepção dos pais de que a regurgitação era um problema esteve associada com a freqüência e o volume da regurgitação, choro aumentado ou irritabilidade, desconforto associado à regurgitação e arqueamento da coluna vertebral”. Esta sugestão é também sustentada por uma maior capacidade de resposta da regurgitação ou choro ao manejo não-farmacológico quando estes sintomas são isolados (24). No entanto, apesar de até 23% dos pais (pico para crianças de 5 meses de idade) considerarem estes sintomas proeminentes e em conjunto como “incômodos” (17), o tratamento (que consiste principalmente de alteração da fórmula ou espessamento dos alimentos) foi administrado em menos de 10% dos casos e medicação em apenas 0,2%. Assim, a identificação dos sintomas e conjuntos de sintomas que servem como marcadores válidos para a DRGE é bastante complexa, e mais ainda por causa da inexistência de padrões-ouro confiáveis, limitações da capacidade de expressão verbal e a necessidade de interpretar os relatos dos pais e/ou cuidadores. Portanto, a definição de “incômodo” torna-se particularmente desafiadora na infância, porque a maioria das crianças não manifesta complicações clinicamente objetivas da DRGE.
A maioria dos adolescentes é suficientemente consciente e comunicativa para ser capaz de determinar se os sintomas são incômodos enquanto que lactentes e crianças pré-escolares terão estas informações relatadas pelos pais ou cuidadores.
No entanto, a questão da comunicação não é determinada apenas pelaidade cronológica. Por exemplo, a história de um pai atento de um menino de 7 ou 8 anos de idade poderia ser pelo menos tão confiável quanto ode um adolescente birrento ou alguém que por uma questãode princípio, insiste em contrariar os pais. Para ser definida como a DRGE, os sintomas de refluxo devem ser incômodos para o lactente, para a criança e para o adolescente, e não simplesmente ser incômodo para o cuidador. Ademais, existem pacientes assintomáticos ou incapazes de relatar sintomas incômodos (lactentes ou crianças com alterações neurológicas) que também apresentam complicações do refluxo, e, portanto, devem ser incluidos nos critérios para a definição da DRGE.
7. Regurgitação em Pediatria é definida como a passagem do conteúdo refluido pela faringe, boca ou através da boca.
Concordância: 100% (A +, 12,5%; A, 87,5 %; Grau: não aplicável).
8. Vômito bilioso não deve ser diagnosticado como DRGE.
Concordância: 100% (A+, 75%; A, 12,5%; A-, 12,5%; Grau: alto).
Regurgitação ocorre quando o relaxamento do esfíncter esofágico inferior permite o movimento retrógrado do conteúdo gástrico para o esôfago e para o exterior. Regurgitação é fisiologicamente diferenciada de vômito pela ausência de: (i) reflexo emético do sistema nervoso central, (ii) contrações retrógradas do intestino delgado, (iii) náusea, e (iv) ânsia de vômito (25). A regurgitação em geral é caracterizada por não ser acompanhada por esforço ou projeção do conteúdo refluído, apesar de que nos lactentes às vezes parece ser forçada (26). Por esta razão, a definição de Montreal foi alterada para, em Pediatria, incluir a ejeção do refluído pela boca. Cuidadores e pais usam outros termos como derramar, golfar, cuspir, os quais, todos eles, englobam a definição de regurgitação. Vômito bilioso é um sinal de alarme que sugere maiores investigações no sentido de pesquisar anormalidades anatômicas, como má rotação intestinal ou doença aguda com sinais de processo obstrutivo intestinal.
9. Regurgitação é um sintoma característico de refluxo em lactentes, mas não é necessário nem suficiente para o diagnóstico da DRGE, porque não é sensível nem específico.
Concordância: 100% (A+, 62,5%; A, 37,5%; Grau: alto).
A especificidade da regurgitação para o diagnóstico da DRGE é dificultada pela freqüência de sua ocorrência em condições normais (vide comentário 4) (17,18), e pelas dificuldades em distinguir de vômito e de uma miríadede condições que causam vômitos em crianças.
Quantitativamente regurgitações mais freqüentes podem prever a existência futura da DRGE em algumas crianças. Em um estudo de coorte prospectivo (18), lactentes regurgitando 90 dias ou mais durante os dois primeiros anos de vida (“regurgitadores frequentes”) foram mais susceptíveis de apresentar sintomas de refluxo, tais como pirose, vômito ou regurgitação ácida, quando seguidos até os 9 anos de idade, do que aqueles que não regurgitavam. Outro estudo, envolvendo lactentes, mostrou diferenças quantitativas no que se refere aos episódios de regurgitação e entre biópsias esofágicas e estudo de pHmetria, positivas e negativas (12). Da mesma forma, o diagnóstico da DRGE tornou-se mais específico em crianças com regurgitação associada a choro excessivo, quando o monitoramento da pHmetria de 24 horas foi usado como padrão-ouro (27-29). Embora tais parâmetros isolados sejam insuficientes tanto para estabelecer quanto para excluir o diagnóstico da DRGE em um paciente, a quantificação e a correspondência da regurgitação com outros sintomas tem se mostrado importantes para aumentar a sensibilidade e a especificidade, como é refletido pelos scores do I-GERQ (Questionário para crianças com refluxo gastro-esofágico) (12). Revisões e validações posteriores deste instrumento mostraram uma boa performance avaliativa por meio de traduções validadas em diversos idiomas para os I-GREQ-R (I-GERQ revisto) (30).
Questões persistentes a respeito do diagnóstico baseado em sintomas em crianças incluem a replicação da validade do diagnóstico a partir de estudos adicionais usando padrões-ouro objetivos com a participação de grupos controle sintomáticos mas desprovidos da DRGE.
Um determinado estudo foi incapaz de confirmar a validade diagnóstica original utilizando o escore do I-GERQ, porém deve-se fazer a ressalva de que o questionário havia sido modificado e traduzido de forma livre antes de ser aplicado. Além disto, a histologia foi empregada somente em uma minoria dos casos e os métodos usados não foram validados para sua necessária confiabilidade (31). A aplicação de padrões-ouro invasivos em crianças, particularmente aquelas do grupo controle torna-se um desafio, aumentando a indefinição do diagnóstico baseado em sintomas para a DRGE em crianças.
10. Sintomas da DRGE, particularmente em lactentes, podem ser indistinguíveis daqueles de alergia alimentar.
Concordância: 100% (A+, 62,5%; A, 25%; A-, 12,5%; Grau: alto).
Em crianças, a DRGE e alergia às proteínas do leite de vaca e da soja podem ambas se manifestar através de regurgitações e/ou vômitos, choro, agitação ou irritabilidade relacionados à alimentação, ou pelo baixo ganho ponderal (32). Consequentemente, distinguir a DRGE da alergia alimentar é difícil levando-se em conta apenas o quadro clínico (33, 34). Alergia à proteína do leite de vaca e a DRGE podem coexistir e a instituição de uma dieta baseada em hidrolisados protéicos pode extinguir os sintomas sugestivos da DRGE (13, 34, 35).
11. Na prática clínica, adolescentes são, em geral, capazes de descrever sintomas típicos da DRGE e determinar se estes sintomas são um problema.
Concordância: 100% (A+, 62,5%; A, 37,5%; Grau: baixo).
Crianças escolares e adolescentes, neurologicamente saudáveis, são geralmente capazes de descrever seu quadro clínico e determinar se estes sintomas de refluxo representam um problema. Uma ressalva quanto a adolescentes birrentos é mencionada no comentário relacionado às afirmações de 3 a 6. Em uma pesquisa comparando os sintomas de refluxo relatados por adolescentes com os relatados por seus pais, 5,2% dos adolescentes de 10 a 17 anos descreveram pirose, e 8,2% relataram regurgitação ácida (36). Em contraste, os pais relataram taxas menores dos mesmos sintomas (3,5 e 1,4%, respectivamente). Esta discrepância mostra a importância da auto descrição dos sintomas nesta faixa etária, embora também possa indicar algum grau de auto-sugestão.
12. Estudos populacionais em Pediatria sobre os sintomas de refluxo são insuficientes e são prioritários para futuras pesquisas.
Concordância: 100% (A+, 75%; A, 25%; Grau: não aplicável).
Uma série de estudos dá uma indicação da prevalência da DRGE na população pediátrica, mas várias metodologias e definições têm sido usadas. Usando um banco de dados de atenção primária do Reino Unido, a incidência estimada do RGE entre 2 e 19 anos de idade foi de 0,47 e 0,77 por 1000 pessoas-ano no sexo masculino e no feminino, respectivamente (37). Em outro estudo, uma revisão de prontuários realizada em serviços de atenção à saúde, primários e terciários, revelou uma incidência de RGE de 0,9 por 1000 pessoas-ano em lactentes e crianças menores de 5 anos de idade (38).
Um estudo nos Estados Unidos utilizando um questionário apropriado (11), envolvendo 1286 adolescentes, de 14 a 18 anos de idade, estudantes do ensino médio, revelou que pirose ocorreu diariamente ou algumas vezes por semana em 0,7 e 3,3%, respectivamente; regurgitação teve uma prevalência similar e disfagia ligeiramente inferior. No entanto, nenhum estudo englobou ainda uma amostragem da população pediátrica geral usando uma definição padronizada para a DRGE. Por conseguinte, estudos populacionais consistentes, levando em consideração as definições padrão da DRGE, são prioritários para futuras pesquisas clínicas.
CONDIÇÕES QUE PREDISPÕEM A DRGE GRAVE E CRÔNICA
13. O paciente pediátrico com alterações do sistema nervoso central tem risco aumentado para a DRGE.
Concordância: 100% (A+, 62,5%; A, 12,5%; A- 25%; Grau: alto).
14. Atresia esofágica está associada com risco aumentado para a DRGE.
Concordância: 100% (A+, 75%; A, 12,5%; A-, 12,5%; Grau: alto).
15. Fibrose cística está associada com risco aumentado para a DRGE.
Concordância: 100% (A+, 75%; A, 12,5%; A-, 12,5; Grau: Alto).
Determinados distúrbios subjacentes predispõem os pacientes pediátricos à DRGE mais grave e crônica, e suas complicações (Tabela 2) (39-46).
Estas incluem alterações neurológicas importantes, tais como paralisia cerebral, doenças genéticas como a síndrome Cornelia de Lange e síndrome de Down; anomalias esofágicas congênitas, tais como, atresia esofágica corrigida ou hérnia diafragmática congênita e doenças pulmonares crônicas, tais como, a fibrose cística.
Por outro lado, crianças saudáveis e adultos com hérnia hiatal ou com uma forte história familiar da DRGE, esôfago de Barrett ou adenocarcinoma esofágico também têm uma maior prevalência da DRGE crônica com complicações (40,47,48). Embora os dados disponíveis na Pediatria sejam escassos, em adultos, obesidade e aumento de peso também estão associados com um significativo aumento na prevalência da DRGE grave, esôfago de Barret e adenocarcinoma do esôfago (49,50).
Tabela 2- Condições predispondo pacientes pediátricos a DRGE grave e crônica
. Alterações neurológicas
. Anomalias congênitas esofágicas (por ex: atresia esofágica, hérnia diafragmática congênita)
. Fibrose cística
. Hérnia hiatal
. Obesidade
História familiar de DRGE grave ou de esôfago de Barret ou de adenocarcinoma esofágico
Síndromes sintomáticas da DRGE
Síndrome Típica de Refluxo
16. Pirose em crianças escolares é definida como uma sensação de queimação na região retroesternal.
Concordância: 100% (A+, 50%; A, 37,5%; A-, 12,5%; Grau: não aplicável).
17. Pirose em adolescentes é definida como uma sensação de queimação na região retroesternal.
Concordância: 100% (A+, 87,5%; A, 12,5%; A-, 12,5%; Grau: não aplicável).
Pirose é definida como a percepção de uma sensação desconfortável de queimação atrás do esterno que pode ser qualificada como dor (1).
Temas a respeito da confiabilidade dos relatos estão registrados nos comentários sob as afirmações de 3 a 6.
18. A síndrome típica do Refluxo é caracterizada por pirose com ou sem regurgitação.
Concordância: 100% (A+, 87,5%; A, 12,5%; A-, 12,5%; Grau: não aplicável).
19. Pirose e regurgitação em adolescentes e pré-adolescentes com desenvolvimento cognitivo suficiente para relatar seus sintomas de forma confiável são sintomas característicos da Síndrome Típica do Refluxo Gastroesofágico.
Concordância: 100% (A +, 62,5%; A, 37,5%. Grau: não aplicável).
Esta afirmação somente se aplica para crianças e adolescentes que são capazes de relatar de forma confiável seus sintomas. Os dados sugerindo que pirose e regurgitação são preditivos da DRGE são derivados de estudos realizados com adultos (1) e crianças (10, 51, 52).
20. Síndrome típica do Refluxo não pode ser diagnosticada em lactentes e em crianças que não tem desenvolvimento cognitivo para relatar sintomas de forma confiável.
Concordância: 75% (A+, 37,5%; A, 37,5%; A-, 12,5%; Grau: não aplicável).
Os problemas com relação à confiabilidade dos relatos de sintomas em crianças abaixo dos 8 anos de idade estão descritos no comentário da afirmação 1 e em outros locais deste documento.
Essa afirmação reflete aqueles pontos de vista anteriormente mencionados, porém, deve-se levar em consideração o amplo espectro da votação final registrada, que mostrou as diferenças de opinião dentro do próprio grupo, quanto à capacidade de se confiar na informação dos sintomas fornecidas por cuidadores de crianças menores de 8 anos de idade, as quais não possuem a capacidade de expressão verbal suficientemente confiável versus a necessidade de realização de testes invasivos para o diagnóstico da DRGE nessa faixa etária.
A confiabilidade (precisão, consistência interna, teste – reteste e concordância entre observadores) de cada item e da validade geral (tanto para o diagnóstico quanto avaliativos, para o rastreamento de alterações ao longo do tempo) com relação às informações prestadas pelos cuidadores, pode ser testada através da validação de questionários destinados a avaliar a DRGE. Considerando-se que, como anteriormente afirmado, a magnitude do conjunto dos sintomas pode ser empregada para definir o RGE, esses instrumentos têm sido desenvolvidos para investigar crianças (9,30); muito embora, deve-se levar em conta que em apenas um estudo um padrão-ouro objetivo foi utilizado para estabelecer a validade diagnóstica (12).
A validade diagnóstica dos questionários para os sintomas da DRGE continua a ser problemática devido à ausência de padrões-ouro objetivos que sejam genéricos para o diagnóstico da DRGE, em especial nas faixas etárias mais jovens. Na falta de um meio de validação diagnóstica universalmente reconhecido, estes instrumentos, no entanto, podem ser usados para uma quantificação confiável dos sintomas a partir da anamnese e do seguimento dos pacientes ao longo do tempo (8). Definitivamente, mais trabalhos nesta área-chave são necessários.
21. O RGE em crianças escolares e adolescentes é a causa mais comum de pirose.
Concordância: 87,5% (A+, 37,5%; A, 50%; D-, 12,5%; Grau: baixo).
22. Pirose em crianças escolares e adolescentes pode ter um número de causas não relacionadas ao refluxo. A prevalência destas é desconhecida.
Concordância: 100% (A+, 50%; A, 37,5%; A-, 12,5%; Grau: alto).
Existe uma evidência convincente de que o refluxo ácido é a causa mais comum de pirose em adultos (1). Refluxo fracamente ácido, refluxo não ácido, gás e refluxo duodeno-gástrico também podem ser causas de pirose em adultos e crianças (53,54). Outras causas de pirose em pacientes adultos e pediátricos incluem: esofagite eosinofílica, pirose funcional, infecções do esôfago e doença de Crohn (55-57).
23. Em adolescentes neurologicamente saudáveis a Síndrome Típica do Refluxo pode ser diagnosticada baseada nos sintomas característicos, sem a necessidade de testes diagnósticos adicionais.
Concordância: 87,5% (A+, 12,5%; A, 62,5%; A-, 12,5%; D-, 12,5; Grau: baixo).
A Síndrome Típica do Refluxo em adultos foi definida com base nos sintomas, isto é, testes diagnósticos adicionais não são necessariamente requeridos (1). Um diagnóstico baseado em sintomas da Síndrome Típica do Refluxo pode ser estabelecido em adolescentes e em crianças maiores de 8 anos de idade que tenham habilidades cognitivas para relatar os sintomas com confiabilidade.
24. A Doença do Refluxo não erosiva em pacientes pediátricos é definida pela presença de sintomas incômodos causados pelo refluxo do conteúdo gástrico e pela ausência de lesões da mucosa durante a avaliação endoscópica.
Concordância: 100% (A+, 12,5%; A, 75%; A-, 12,5%; Grau: não aplicável).
Sintomas associados ao refluxo não acompanhados por lesões da mucosa esofágica são denominados de DRNE (doença do refluxo não erosiva), em contraste com a DRE (doença do refluxo erosiva) (57, 58). A DRNE aparece em dois terços dos adultos com doença do refluxo (1). Adultos com a DRNE diferentemente daqueles com a DRE são predominantemente mulheres, com baixo índice de massa corporal, alta prevalência de transtornos gastrointestinais funcionais, hipersensibilidade ácida esofágica e baixa resposta aos inibidores da bomba de prótons (IBPs).
Adultos com a DRE apresentam mais frequentemente hérnia hiatal e maior exposição ácida e dismotilidade esofágica do que aqueles com a DRNE (55,57).
O diagnóstico da DRNE somente se aplica a adolescentes e crianças que tem habilidades cognitivas para relatar sintomas de forma confiável, isto é, aqueles com pelo menos 8 anos de idade. Portanto, existem poucos dados em Pediatria comparando a DRNE com a DRE com respeito a apresentação dos sintomas, prevalência, fisiopatologia e respostas à terapia (10, 52, 59). Várias alterações endoscópicas da mucosa esofágica são descritas em adultos com a DRNE usando a endoscopia de magnificação. Estas incluem: aumento da trama vascular, superfície mucosa com aparência de vilosidades (metaplasia intestinal), ilhas de epitélio escamoso abaixo da linha Z e estrias hiperemiadas (60). Existem poucos dados a respeito destes achados em crianças. O diagnóstico da DRNE não pode ser estabelecido ou descartado pela histologia (Vide também as afirmações 33 e 34, em relação à histologia).
25. Dor epigástrica em crianças escolares e adolescentes pode ser um sintoma maior da DRGE.
Concordância: 100% (A+, 75%; A-, 25%; Grau: moderado).
Em alguns estudos, os indivíduos puderam relatar dor epigástrica e dor abdominal (10, 15), mas estes termos não são nem sensíveis, nem específicos para o diagnóstico da DRGE. Mais estudos nesta área, particularmente em pacientes pediátricos com sintomas relacionados ao andar superior do abdome são necessários.
26. A DRGE em recém nascidos e lactentes pode estar associada a distúrbios do sono.
Concordância: 87,5% (A+, 25%; A, 25%; A-, 37,5%; D+, 12,5%; Grau: baixo).
27. A DRGE em crianças pré-escolares e escolares pode estar associada a distúrbios do sono.
Concordância: 100% (A+, 12,5%; A, 37,5%; A-, 50%; Grau: muito baixo).
28. A DRGE em adolescentes pode estar associada a distúrbios do sono.
Concordância: 100% (A+, 62,5%; A-, 37,5%; Grau: muito baixo).
Em estudo baseado em um questionário realizado com mais de 16.000 adultos em cinco países europeus, o refluxo noturno mostrou-se associado com obesidade (Índice de Massa Corporal > 30), sintomas de reatividade das vias aéreas e roncos (61). Em crianças são limitados os dados disponíveis para sustentar as relações entre a DRGE e os distúrbios do sono. Um relato de caso descreve laringoespasmo em uma menina de 8 anos de idade com asma que foi despertada durante o sono com distúrbios respiratórios e que mostrava queda do pH intraesofágico antes dos episódios de estridor (62). Otorrinolaringologistas consideram a DRGE como uma co-morbidade em crianças com Síndrome de Down que apresentam sintomas de obstrução das vias aéreas superiores, incluindo apnéia obstrutiva do sono (63). São necessários estudos adicionais a fim de confirmar esta relação de causa e efeito. Entre 50 crianças saudáveis com regurgitação ocasional, refluxo ácido no esôfago proximal mostrou-se fortemente associado com o despertar do sono, mas não está claro se o despertar levou a episódios de refluxo ou se o refluxo ácido foi o causador do despertar (64). Em crianças acima dos 36 meses de idade houve uma maior freqüência de despertar noturno entre 76 pacientes com pHmetrias anormais comparados com 3.102 controles (65). Em um estudo não controlado, o distúrbio do sono em 22 pacientes pareceu aumentar com o uso de agente pro-cinético (66). Em resumo, apesar de a DRGE estar associada a distúrbios do sono, a relação causa-efeito e o sentido de qualquer causalidade ainda precisam ser comprovadas.
29. Exercícios físicos em lactentes e crianças podem induzir sintomas incômodos da DRGE em indivíduos que não têm ou têm sintomas mínimos em outras ocasiões (refluxo induzido pelo exercício).
Concordância: 87,5% (A, 12%; A-, 75%; D-, 12,5%; Grau: muito baixo).
30. Exercícios físicos em adolescentes podem induzir sintomas incômodos da DRGE em indivíduos que não têm ou têm sintomas mínimos em outras ocasiões (refluxo induzido pelo exercício).
Concordância: 100% (A+, 25%; A, 25%; A-, 50%; Grau: muito baixo).
A DRGE induzida por exercício é entidade bem estabelecida em adultos e parece estar relacionada ao refluxo induzido por tensão, o qual tem como causa o aumento da pressão intra-abdominal (1). Evidência para a existência da DRGE induzida por exercícios em crianças é escassa e primariamente especulativa por natureza. Casos de sintomas respiratórios induzidos pelo exercício foram relacionados com refluxo em um estudo com 14 crianças sem asma na ausência de sintomas típicos da DRGE (67).
31. Quando se pesquisa a DRGE, ruminação deve ser diferenciada da regurgitação. Concordância: 100% (A+, 62,5%; A, 25%; A-, 12,5%; Grau: não aplicável).
Ruminação se refere à regurgitação, sem esforço até a boca, de alimento recentemente ingerido, com subsequente mastigação e re-ingestão do alimento. A síndrome da ruminação tem sido crescentemente reconhecida entre crianças maiores, especialmente entre meninas adolescentes, e é considerada por alguns como uma alteração dentro do espectro dos transtornos alimentares (68). Características que diferenciam a ruminação da regurgitação devido a DRGE incluem regurgitação que se inicia durante a alimentação ou imediatamente, até mesmo, depois de beber um copo d’água. Além disso, a ruminação está associada à ausência de refluxo patológico noturno ou quando o paciente encontra-se recostado, falta de resposta aos pro- cinéticos ou à supressão ácida, e tem uma preponderância nas mulheres (69,70).
Ruminação é comum em lactentes e crianças com deficiências neurológicas, mas também pode ocorrer em indivíduos sem deficiências neurológicas óbvias. A Síndrome da Ruminação do Lactente é um transtorno raro caracterizada por regurgitação voluntária habitual do conteúdo gástrico até a boca por auto estimulação (71), e pode ser um sinal de privação social. Os atuais critérios de ROMA III sobre a Síndrome da Ruminação requerem que a DRGE seja considerada como diagnóstico diferencial (68).
SÍNDROMES COM LESÃO ESOFÁGICA
32. Em pacientes pediátricos, as complicações esofágicas da DRGE são esofagite de refluxo, hemorragia, estenoses, esôfago de Barret, e, raramente, adenocarcinoma.
Concordância: 100% (A+, 62,5%; A, 25%; A-, 12,5%; Grau: alto).
Existem complicações bem reconhecidas em crianças, bem como em adultos. Esofagite erosiva ocorre em mais de um terço dos pacientes na faixa etária pediátrica com distúrbios subjacentes promotores da DRGE, tais como: deficiências neurológicas ou atresia esofágica (72). Esofagite erosiva é mais prevalente e grave nestes últimos (afirmações de 13 a 15), como estenoses, esôfago de Barrett e adenocarcinoma.
Esofagite de refluxo
33. Existem dados insuficientes para recomendar a análise histológica como uma ferramenta para diagnosticar ou excluir a DRGE em crianças.
Concordância: 87.5 % (A+, 37.5 %; A, 25 %; A−, 25 % ; D+ , 12.5 %;Grau: não aplicável).
34. Um papel primário da análise da histologia esofágica é descartar outras condições como diagnóstico diferencial.
Concordância: 100% (A+, 37,5%; A, 50%; A-, 12,5%; Grau: alto).
Diversas variáveis influenciam a validade da histologia como uma ferramenta de diagnóstico para a esofagite de refluxo (73,74).
Erro de amostragem é uma variável de viés intrínseca, porque a esofagite de refluxo apresenta característica de distribuição focal. Variáveis adicionais que tem impacto sobre a reprodutibilidade incluem: falta de padronização dos locais de biópsia, as técnicas de montagem, orientação e corte de tecido, escolha do fixador e interpretação dos parâmetros morfométricos. A seguir são relatados os parâmetros de lesões que mais comumente são descritos.
Hiperplasia da camada basocelular e alongamento das papilas.
Existem alterações reativas não específicas devidas à DRGE. Por exemplo, elas podem estar presentes na esofagite eosinofílica, na Doença de Crohn, e nas infecções (75). Além do que, elas podem ser encontradas em adultos sintomáticos e assintomáticos, com estudos de pHmetria normais ou anormais (76), e em voluntários adultos assintomáticos cujo esfíncter esofágico inferior media 2,5 cm por meio da manometria esofágica e, proximalmente, ainda mais do que 2,5 cm (77).
Eosinófilos têm sido encontrados na mucosa esofágica de crianças com a DRGE (82), mas isso foi descrito em uma era anterior ao atual conhecimento da existência da esofagite eosinofílica e da esofagite por alergia ao leite ou a outras proteínas. Presentemente, sabe-se que existe uma considerável sobreposição entre os achados histológicos na DRGE, na esofagite eosinofílica (56, 83) e na sensibilidade à proteína de determinados alimentos (32, 84, 85). Por outro lado, eosinófilos são encontrados em biópsias de crianças normais e adultos assintomáticos (75, 86) e em crianças com alergia à proteína do leite de vaca (32, 84, 85). No estudo acima citado, utilizando biópsias de sucção obtidas em crianças com sintomas sugestivos da DRGE (80), somente 12% apresentavam alguns eosinófilos, apenas 2% tinham mais do que 5 eosinófilos por campo de grande aumento, e nenhum dos casos que apresentava mucosa morfometricamente normal deixou de ter algum eosinófilo. Antes da realização da biópsia esofágica, estas crianças tinham sido pré-tratadas por 2 semanas com fórmula extensamente hidrolisada. A densidade eosinofílica em crianças não se relaciona com a intensidade do refluxo pelo estudo da pHmetria ou pela endoscopia (84, 87-89). Mesmo quando presentes em adultos com a DRGE, os eosinófilos não acrescentam sensibilidade diagnóstica aos outros parâmetros de avaliação (79). Eosinófilos esofágicos são também observados na Doença de Crohn e infecções pelo citmegalovirus, Herpes simplex e Candida albicans (75).
Combinações
Em vários estudos que consideram os parâmetros acima, tanto isoladamente quanto conjuntamente, para o diagnóstico da DRGE em crianças, uma pobre correlação entre a histologia do esôfago e os sintomas, os achados endoscópicos ou o monitoramento do pH foi descrita (28, 31, 88). Eosinófilos e alterações reativas também são vistos separadamente e em conjunto em crianças com intolerância à proteína alimentar (32,75). Esses parâmetros estão presentes em apenas aproximadamente 67% dos adultos com a DRNE (73).
Espaços intercelulares dilatados (DIS)
Também conhecida como “espongiose” ou “edema intercelular”, espaços intercelulares dilatados (DIS) são um parâmetro novo. DIS estão presentes em 41-100% dos adultos com DRNE vs. 0-30% dos controles (73). DIS também ocorreram em crianças (90), mas neste estudo, o diagnóstico da DRGE foi baseado em outras alterações reativas às descritas acima e as características clínicas dos controles permaneceram pouco esclarecidas. Neste estudo, os DIS também foram descritos na esofagite eosinofílica, na alergia alimentar, e na candidíase esofágica. DIS estão presentes em pacientes sintomáticos com pHmetria esofágica normal (91) e em estudos ultra-estruturais os quais desaparecem após o tratamento com IBPs, porém grupos placebo ainda não foram avaliados (92). Além disso, DIS não desapareceram em todos os estudos realizados após intervenções terapêuticas (74).
Outra consideração diz respeito à necessidade da boa condição de preservação dos tecidos disponíveis para análise. Por exemplo, mesmo em estudos cuidadosamente realizados que foram efetuados segundo protocolo, 7-12% dos pacientes foram excluídos da análise adicional porque o tecido do material da biópsia não permitiu uma análise confiável (79, 80).
Em geral, todos os dados acima foram derivados de estudos em Serviços especializados, usando cuidadosamente o protocolo para a realização e preservação do material das biópsias quanto à coleta, montagem, fixação e técnicas de corte, bem como os métodos morfométricos empregados, incluindo a avaliação ultraestrutural. Essas metodologias variam entre os diversos Serviços. Estas metodologias e as conclusões descritas provavelmente representam os melhores resultados obtidos, e, desta forma, não podem ser necessariamente extrapoladas para as práticas clínicas rotineiras de endoscopia e patologia em Pediatria, quando são utilizadas biópsias endoscópicas, as quais são analisadas à microscopia óptica de luz.
O conceito de que danos microscópicos estão presentes na DRGE é atraente e intuitivo, e os parâmetros acima considerados ocorreram com mais freqüência em pacientes sintomáticos com suspeita da DRNE e da DRGE do que em controles saudáveis. No entanto, as alterações não são específicas de refluxo. Portanto, neste momento, a função principal da histologia esofágica na prática clínica é diagnosticar ou descartar outras causas de esofagite que têm resultados histológicos específicos, incluindo: esofagite eosinofílica, esôfago de Barrett, doença de Crohn, infecção e a doença do enxerto versus hospedeiro.
Entre os lactentes com sintomas de esofagite de refluxo ao ingressarem no estudo e que se tornaram assintomáticos ao receberem placebo em uma pesquisa de farmacoterapia, essas alterações histológicas mantiveram-se presentes mesmo após 1 ano de acompanhamento, embora não se saiba se a resolução dos sintomas fosse equivalente à resolução do refluxo patológico (78).
Resultados compilados (73) de vários estudos em adultos com a DRNE mostrou alongamento papilar presente em 0 a 85% dos pacientes, em relação aos controles, o qual estava presente de 5 a 20%. Quanto à espessura da camada basocelular, três estudos controlados relataram uma maior espessura da mesma em indivíduos sintomáticos que em controles (73), mas apenas em um estudo a diferença foi estatisticamente significante (79); além disso, há uma grande variação de resultados entre os estudos disponíveis na literatura (73). Considerando-se a análise de 497 biópsias de sucção realizadas em crianças sintomáticas, 85% das medidas papilares e 94% das medidas da camada basal foram avaliadas como anormais (80). Outro estudo avaliando biópsias esofágicas de sucção em lactentes mostrou uma significativa diferenciação morfométrica entre o normal e tres graus distintos de esofagite (81). O pH esofágico não foi avaliado em nenhum destes estudos, e por isto, a relação entre as alterações morfométricas e o refluxo ácido permaneceu sem esclarecimento.
Eosinófilos
35. Esofagite de refluxo em Pediatria é definida endoscopicamente por meio de lesões visíveis na mucosa esofágica distal.
Concordância: 62.5% (A+, 50 %; A−, 12,5 %; D, 12.5 %; D+, 25%:Grau: não aplicável).
Em adultos existe uma forte evidência de que lesões visíveis na mucosa são as mais confiáveis evidências de esofagite (1). Globalmente considerou-se que os elementos de prova em adultos podem ser suficientes para recomendar que esta afirmação também se aplique às crianças. Erosões também são um parâmetro bem estabelecido de esofagite em crianças (51,72,93). O termo “esofagite de refluxo,” em vez de “esofagite erosiva,” enfatiza que esta afirmação aborda esofagite causada pelo refluxo e não por outras causas, como vômito forçado, doença de Crohn, infecção, pílulas e ingestão de cáusticos. Não foi alcançado consenso para esta afirmação porque alguns participantes entenderam que esofagite também deve ser definida pela histologia. No entanto, o Comitê posteriormente reexaminou as evidências histológicas e considerou que, tal como é atualmente realizada a análise histológica, esta não tem utilidade para diagnosticar ou para afastar esofagite de refluxo (afirmações 33 e 34 acima).
36. Quando as erosões relacionadas ao refluxo estão presentes à endoscopia, o grau deveria ser descrito de acordo com uma das reconhecidas classificações de esofagite erosiva.
Concordância: 100% (A+, 50%; A, 50%; Grau: não aplicável).
A presença e a gravidade da esofagite de refluxo caracterizadas no momento da endoscopia digestiva alta determinam a tomada de decisões a respeito da conduta clínica, e permitem avaliar os resultados do tratamento. Classificações endoscópicas são usadas para definir a gravidade da doença erosiva, pela presença e extensão das erosões da mucosa. Achados endoscópicos devem ser descritos em termos bem definidos e reprodutíveis, para que comparações entre observadores possam ser feitas. Embora validada para adultos, a classificação endoscópica de Hetzel e Dent (94) foi a mais usada em estudos pediátricos (51, 93, 95). A classificação de Los Angeles é amplamente utilizada em adultos (96) e também é empregada na prática pediátrica.
37. Em pacientes pediátricos saudáveis até o momento de apresentarem sintomas do RGE, esofagite de refluxo pode não se tornar crônica ou recorrente após o tratamento.
Concordância: 100% (A+, 12,5%; A, 75%; A−, 12,5% ; Grau: baixo).
38. Refluxo gastroesofágico, em pacientes com deficiências neurológicas, atresia de esôfago corrigida, hérnia hiatal e doenças respiratórias crônicas, é usualmente crônico e recorrente.
Concordância: 87,5% (A+, 12,5%; A, 62,5%; A-, 12,5%; D, 12,5%; Grau: moderado).
Em um estudo duplo-cego controlado randomizado com 48 crianças saudáveis até o momento de apresentarem sintomas do RGE com esofagite erosiva curada por uso de IBPs, Bocchia e cols. (93) verificaram que uma recaída da esofagite de refluxo, até 3 meses após a suspensão do tratamento de manutenção, ocorreu em apenas uma criança. Recorrência de sintomas relevantes também foi incomum (<15%) durante o período de acompanhamento de 30 meses. Além deste estudo, há poucos dados disponíveis sobre as taxas de recaída em crianças saudáveis. Por outro lado, as crianças com transtornos subjacentes que predispõem à DRGE grave (afirmações de 13 a 15) têm graus superiores de esofagite erosiva do que no estudo realizado por Bocchia e cols., e são mais propensas a ter esofagite erosiva crônica recidivante (40,95).
39. Embora a intensidade e a frequência dos sintomas do RGE em pacientes pediátricos se correlacionem com a gravidade das lesões da mucosa, não há possibilidade de se prever com acurácia a gravidade das lesões da mucosa em um paciente isoladamente.
Concordância: 100% (A+, 12,5%; A, 62,5%; A−, 25%, Grau: baixo).
Em adultos, a freqüência e a gravidade dos sintomas da DRGE têm uma moderada correlação com a gravidade da lesão da mucosa (1). Em um estudo com 129 pacientes (1-17 anos de idade) com a DRGE, que foram submetidos a endoscopia e avaliação dos sintomas (10), a prevalência e a gravidade dos sintomas de anorexia e recusa alimentar foram significativamente maiores em crianças com esofagite erosiva do que naquelas com a DRNE.
Por outro lado, em lactentes, os sintomas não predizem confiavelmente a presença de esofagite (31,78). Atualmente não é possível prever com acurácia a gravidade das lesões mucosas em pacientes pediátricos com base em sintomas isolados. É importante assinalar e diferenciar que a lesão da mucosa tenha sido definida por endoscopia em um estudo (10) e pela histologia nos demais (31,78). Esta discrepância ilustra a necessidade de uma maior precisão na definição da DRGE na prática pediátrica.
Estenose de refluxo
40. A estenose de refluxo é definida como um estreitamento luminal do esôfago causado pela DRGE em pacientes pediátricos.
Concordância: 100% (A+, 75%; A, 25%; Grau: não aplicável).
41. O sintoma característico da estenose em pacientes pediátricos é a presença de disfagia persistente
Concordância: 100% (A+, 37,5%; A, 50%; A-, 12,5%; Grau: alto).
42. Disfagia em crianças escolares e adolescentes é a dificuldade perceptível da passagem do alimento da boca para o estômago.
Concordância: 100% (A+, 37,5%; A, 50%; A−, 12,5%; Grau: alto).
43. Disfagia grave está presente quando crianças escolares e adolescentes necessitam alterar os padrões alimentares ou relatam impactação dos alimentos.
Concordância: 100% (A+, 25%; A, 62,5%; A-, 12,5%; D, 12,5%; Grau: não aplicável).
Em uma minoria de pacientes pediátricos, a DRGE leva ao estreitamento do lúmen esofágico. Este estreitamento, por causa do edema ou fibrose, impede a passagem dos alimentos causando disfagia persistente. Consequentemente, disfagia persistente e/ou progressiva é um sintoma de alarme de estreitamento do esôfago e mandatório de investigação adicional. Devem ser diferenciados de outras causas de estreitamento esofágico, em pacientes pediátricos, as quais estão relacionadas com a faixa etária (97). Pacientes pediátricos com esofagite eosinofílica também se apresentam com disfagia. A endoscopia com biópsias esofágicas está indicada para determinar a causa do estreitamento (56).
Esôfago de Barret
44. No grupo pediátrico, esôfago de Barret ocorre principalmente em pacientes com hérnia hiatal e naqueles com outros transtornos associados que predispõem à DRGE grave.
Concordância: 100% (A+, 25%; A, 62,5% ; A-, 12,5%; Grau: baixo).
45. O termo metaplasia esofágica endoscopicamente suspeita (MEES) descreve achados endoscópicos consistentes com esôfago de Barret que aguardam confirmação histológica.
Concordância: 100% (A+, 25%; A, 75%; Grau: não aplicável).
46. Documentação das áreas limítrofes esofagogástricas juntamente com múltiplas biópsias é necessária para caracterizar a MEES.
Concordância: 87,5% (A+, 12,5%; A, 62,5%; A-, 12,5%; D-, 12,5%; Grau: moderado).
47. Quando biópsias da MEES mostram epitélio colunar, isto deve ser chamado de Esôfago de Barret e a presença ou ausência de metaplasia intestinal deve ser especificada.
Concordância: 100% (A+, 50%; A, 37,5%; A-, 12,5%; Grau: não aplicável).
A afirmação 44 é sustentada pelos comentários sobre as afirmações de 13 a 15. Apesar da prevalência do Esôfago de Barret ser muito menor em crianças do que em adultos, ela ocorre. Por exemplo, em um estudo, metaplasia esofágica mostrou-se presente em 10% das crianças com RGE crônico grave, aonde metade das quais, apresentava metaplasia de células caliciformes (40).
Da mesma forma que em adultos (1), em pacientes pediátricos o termo “Esôfago de Barrett” apresenta uma ampla gama de variações (98,99) e, portanto, atualmente não existe a clareza necessária para uma comunicação clínica e científica. O termo “metaplasia esofágica endoscopicamente suspeita” reconhece que a aparência endoscópica pode não ser diagnóstica e requer confirmação histológica (1,100).
Para se identificar com precisão a MEES, os principais limites endoscópicos da junção gastro-esofágica devem estar documentados (101) em centímetros desde os dentes e, idealmente, fotografados (98,102). Quando uma intensa inflamação ou pus prejudicarem a identificação dos limites, a endoscopia deve ser repetida após aproximadamente 12 semanas de tratamento com altas doses dos IBPs. Esta conduta terapêutica auxilia a remoção da camuflagem exsudativa, permitindo, assim, uma identificação mais precisa dos limites desejados (103,104).
Múltiplas biópsias espaçadas são necessárias para minimizar o erro de amostragem, para permitir a caracterização da mucosa como puramente gástrica colunar, ou seja, tipo cardia, ou colunar com metaplasia intestinal e para detectar displasia (1,99). Biópsias dos quatro quadrantes a cada centímetro para segmentos circunferenciais metaplásticos é a abordagem prática mais sensível (1,105). Isso deve incluir tantas biópsias quanto possíveis da linha Z, e imediatamente acima da mesma, porque a probabilidade de se encontrar um número mais elevado da metaplasia de células caliciformes é mais proximal, tanto em crianças quanto em adultos (99,104,106,107).
Tem sido amplamente confirmado que a condição sine qua non para o diagnóstico do esôfago de Barrett é a presença de metaplasia intestinal, ou seja, mucosa colunar contendo células caliciformes que se coram pela mucina ácida com azul de Alcian em pH 2.5 (98,104,108,109). Até o presente momento, nenhuma criança com idade inferior a 5 anos foi descrita com metaplasia de células caliciformes e sabe-se que o aumento do número de células caliciformes se dá ao longo do tempo (107,110). Assim sendo, é mais provável que este tipo de metaplasia avançada leva anos para se desenvolver. Em contraste com a abordagem de “apenas células caliciformes”, relatos recentes em adultos (111) e em crianças (99) mostraram que a metaplasia do esôfago pode ocorrer na forma de metaplasia colunar tipo cárdia sem a presença de células caliciformes. Inclusive este conceito foi considerado o tema mais controverso do grupo de Montreal (1). Técnicas de coloração e interpretação de biópsias também influenciam a sensibilidade da detecção da metaplasia intestinal (100,101). Ademais existem atualmente certas dúvidas se somente mucosas contendo metaplasia de células caliciformes representam uma lesão pré-maligna (1). Com a nova terminologia, quando o termo “Esôfago de Barret” é usado, é essencial especificar se a metaplasia intestinal especializada está presente ou ausente.
SÍNDROMES EXTRA-ESOFÁGICAS
48. Síndrome de Sandifer (torcicolo) é uma manifestação específica da DRGE em pacientes pediátricos.
Concordância: 100% (A+, 62,5%; A-, 37,5%; Grau: alto).
A síndrome de Sandifer se caracteriza por uma postura anormal da cabeça (por ex: inclinação da cabeça ou torcicolo) por causa da DRGE em crianças neurologicamente intactas (113, 114).
49. Não existem evidências suficientes de que a DRGE causa ou exacerba sinusite, fibrose pulmonar, faringite e otite média serosa na população pediátrica.
Concordância: 100% (A 100%; Grau: baixo).
Dados provenientes de estudos em adultos apoiando uma ligação entre a DRGE e estas condições não são conclusivos (1). Um grande estudo retrospectivo caso-controle envolvendo pacientes hospitalizados identificados pelo CID (Classicação International de Doenças) mostrou que, em comparação com os controles, as crianças com a DRGE, sem complicações neurológicas, tiveram um risco duas vezes maior de contrair sinusite, laringite, pneumonia e bronquiectasia, e menos de otite média (115).
No entanto, os critérios utilizados para a definição dos casos da DRGE não foram claramente explicitados a priori e eram variáveis. Além disso, as conclusões alcançadas poderiam ser o resultado de um viés de seleção, porque os pacientes com diagnóstico de sinusite, laringite, pneumonia e bronquiectasias poderiam ter sido seletivamente admitidos para investigação da DRGE. Outros estudos com pacientes pediátricos relatam uma associação entre refluxo ácido e otite média serosa (116,117). Ensaios controlados de tratamento de pacientes pediátricos com a DRGE e manifestações otorrinolaringológicas, com tamanho suficiente para coorte, definição de caso padrão e resultados claramente definidos, seriam necessários para dar sustentação a uma relação de causa e efeito.
50. Tosse crônica, laringite crônica, rouquidão e asma podem estar associados com a DRGE.
Concordância: 87.5% (A+, 25%; A, 37,5%; A−, 25%; D−, 12,5 %; Grau: muito baixo).
51. Na ausência de pirose ou regurgitação, asma inexplicável tem menor probabilidade de estar relacionada à DRGE.
Concordância: 100% (A+, 12.5%; A, 75%; A−, 12.5%; Grau: baixo).
52. Tosse crônica, laringite crônica, rouquidão e asma são processos multifatoriais de doença e refluxo ácido pode ser um co-fator agravante.
Concordância: 87.5% (A+, 37.5%; A, 25 %; A−, 25%; D−, 12.5%;Grau: muito baixo).
Refluxo ácido que ocorre diretamente através da aspiração ou indiretamente através de constrição brônquica mediada por via neural, tem sido implicado como causa de asma (1). Uma revisão sistemática relatou uma associação entre DRGE e asma em adultos, mas há uma escassez de dados sobre o sentido da causalidade (118). Vários estudos descrevem também uma maior prevalência de sintomas da DRGE em crianças escolares e adolescentes com asma, em comparação com controles saudáveis (119.120). Um estudo com 1.037 crianças seguidas desde o nascimento até os 21 anos de idade para sintomas respiratórios e função pulmonar encontrou uma associação entre sintomas da DRGE (pirose e regurgitação) e asma (OR, razão de probabilidade: 3.2; 95% IC, intervalo de confiança de 95%: 1.6-6.4), chiado (OR: 3.5; 95% IC: 1. 7-7.2), ou tosse noturna (OR: 4.3; 95% IC: 2.8.1-7). No entanto, essa associação só foi encontrada em pacientes com asma de início tardio (adolescente e adulto) e não na asma com início na infância (121).
O maior ensaio clínico controlado de inibição ácida em adultos selecionados com asma persistente moderada a grave não mostrou atenuação dos sintomas, exceto naqueles pacientes com sintomas noturnos do RGE (122). Outro grande estudo em uma população adulta semelhante não mostrou nenhuma atenuação em quaisquer sintomas da asma ou na função pulmonar, mas sim evidenciou uma pequena diminuição no número de exacerbações da asma e no uso de corticóide oral (123). Um estudo envolvendo um número menor de pacientes, duplo-cego placebo controlado, avaliou 38 crianças e não mostrou nenhum benefício com o uso da supressão ácida (124); um ensaio, duplo-cego placebo controlado, recentemente realizado em lactentes não mostrou nenhum benefício da supressão de ácido para combater os sintomas de chiado (14). Por outro lado, uma série não controlada de casos, avaliando crianças escolares selecionadas com asma e a DRGE, mostrou que a fundoplicatura ou o tratamento combinado com IBP/agente pro-cinético foram ambos mais eficazes na prevenção das exacerbações da asma que o tratamento com um antagonista do receptor de histamina-2 (125). Assim, embora existam dados relatando uma associação entre asma e RGE em crianças e adultos, dados mostrando que o RGE provoca asma ou que o tratamento do RGE alivia os sintomas da asma, exigem maior comprovação e são provavelmente relevantes somente para subgrupos de pacientes selecionados. Se esse for o caso, métodos precisos de seleção e identificação de tais grupos são prioritários.
Refluxo ácido tem também sido associado a sintomas laríngeos crônicos em crianças e adultos. Séries retrospectivas de casos sugerem que uma proporção de crianças com rouquidão ou laringite posterior também apresentam RGE (126,127), mas foram aplicados critérios dúbios para o diagnóstico de laringite associada a refluxo (128,129) e à DRGE. Dados de tratamentos em crianças são limitados. Vários estudos recentes de meta-análise, realizados em adultos, indicam que a inibição ácida não tem efeito sobre os sintomas crônicos da laringe atribuídos à DRGE (130-132), portanto, dados de ensaios de tratamento não oferecem sustentação para uma relação causal entre a DRGE e laringite ou rouquidão. Da mesma forma, uma revisão da Cochrane relatou que não há provas suficientes para concluir definitivamente que o tratamento com terapia potente de supressão ácida é benéfico para tosse associada à DRGE em adultos (133).
53. A DRGE pode causar erosões dentárias em pacientes pediátricos.
Concordância: 100% (A+, 12,5%; A, 37,5%; A−, 50%; Grau: baixo).
Uma alta prevalência de erosões dentárias tem sido descrita nas crianças que sofrem da DRGE em comparação com controles saudáveis (134-136). No entanto, outro estudo comparando adultos jovens (19-22 anos de idade) com e sem a DRGE não demonstrou associação entre erosões dentárias e a DRGE (137).
Em vez disso, erosões dentárias estiveram associadas com o nível de consumo de refrigerantes, independentemente do status da DRGE. No entanto, uma análise recente de 17 estudos concluiu que crianças com a DRGE correm um risco aumentado de desenvolver erosões dentárias em comparação com indivíduos saudáveis, risco este similar a aquelas crianças que sofrem de disfunção neurológica (138). A gravidade das erosões dentárias parece estar correlacionada com a presença dos sintomas da DRGE, e também, pelo menos em adultos, com a gravidade da exposição oral ou do esôfago proximal a um pH ácido. Alguns autores recomendam que a inspeção da cavidade oral em busca de erosões dentárias deve ser rotineiramente investigada em pacientes com suspeita da DRGE (138).
54. Existe uma associação entre a DRGE e a displasia bronco-pulmonar em recém-nascidos e lactentes, mas a relação causa-efeito é incerta.
Concordância: 100% (A+, 25%; A, 50%; A−, 25%; Grau: baixo).
Displasia broncopulmonar é uma doença pulmonar crônica da infância com diferentes graus de parada do crescimento alveolar, anormalidades das ramificações aéreas e fibrose peri-bronquiolar, e está associada com a DRGE (139,140). No entanto, um estudo mais recente não confirmou uma associação entre estas duas condições (141). Como a maioria dos estudos tem sido transversais ou caso-controle, continua a ser necessário determinar com precisão se a DRGE é, na verdade, um fator causal predispondo lactentes ao desenvolvimento de displasia broncopulmonar, ou se ocorre por causa desta afecção, ou ainda ambos.
55. Em lactentes prematuros a relação entre o RGE e apnéia patogênica e/ou bradicardia não está estabelecida.
Concordância: 100% (A+, 37,5%; A, 50%; A−, 12,5%; Grau: alto).
56. Embora o refluxo cause apnéia fisiológica, causa episódios apnéicos patológicos em apenas um número muito pequeno de recém-nascidos e lactentes.
Concordância: 100% (A+, 37,5%; A, 37,5%; A−, 25 %; Grau: moderado).
57. Quando o refluxo causa apnéia patológica é mais provável que o lactente seja despertado e que a apnéia seja de natureza obstrutiva.
Concordância: 100% (A+, 25%; A, 25%; A−, 25%; Grau: moderado).
A relação causal entre refluxo e apnéia tem sido assumida há muitos anos, especialmente em recém-nascidos e lactentes. No entanto, a associação de RGE–apnéia poderia simplesmente se relacionar ao fato de que as duas condições são comuns nesta fase da vida. Estudos com impedância e monitoramento do pH tem sido usados para mostrar a relação entre curtos episódios de apnéia fisiológca e refluxo em crianças. Em geral, DRGE e apnéia não parecem temporalmente ligados aos lactentes prematuros “convalescentes assintomáticos” (142), apesar das fortes evidências fisiológicas de que a estimulação dos eferentes laríngeos provoca apnéia central e adução laríngea (143). No entanto, em uma subpopulação de lactentes com comprometimento neurológico, há uma incidência aumentada de ambos, apnéia e RGE. Como alguns relatos de casos indicam que em circunstâncias excepcionais a DRGE deve estar relacionada com apnéia patológica, muitos centros médicos tratam todos os lactentes com apnéia com drogas anti-refluxo. De fato, os dados disponíveis sugerem fortemente que a apnéia não está relacionada com o RGE na maioria das crianças (145).
As ocorrências de eventos agudos com risco de morte são episódios de combinações de apnéia, mudança de coloração, mudanças no tônus muscular, choque, asfixia e engasgos. A DRGE é um diagnóstico frequentemente aventado em crianças após semelhante evento (146). No entanto, dados convincentes não estão disponíveis para definir de forma confiável a prevalência da DRGE em um evento agudo com risco de morte. Na verdade, refluxo gástrico ácido parece estar relacionado a estes eventos em menos de 5% das crianças que apresentam eventos similares (147).
59. Até o momento, nenhum teste diagnóstico isoladamente pode comprovar ou excluir as manifestações extra-esofágicas da DRGE em Pediatria.
Concordância: 100% (A+, 62,5%; A, 37,5%; Grau: não aplicável).
Clínicos utilizam laringoscopia, broncoscopia e lavagem alveolar, endoscopia digestiva, biópsias esofágicas e da laringe, monitoramento do pH na hipofaringe e impedanciometria intra-luminal de múltiplos canais para diagnosticar a DRGE em pacientes pediátricos que apresentam sintomas extra- esofágicos. Entretanto, nenhuma destas ferramentas, isoladamente, estabelece o diagnóstico da DRGE com sintomas extra-esofágicos (148, 149).
A avaliação por pHmetria da hipofaringe foi realizada em crianças com sintomas sugestivos de manifestação extra-esofágica da DRGE. Em um estudo prospectivo com 222 crianças (1 dia a 16 anos de idade), divididas em subgrupos por sintomas (laríngeos, pulmonares, vômitos recorrentes e sintomas não respiratórios), 78 tinham refluxo faríngeo apesar dos traçados de pH esofágicos distais normais (150). As crianças com vômitos, sintomas pulmonares e sintomas da laringe tinham mais episódios de refluxo faríngeo em comparação com as crianças com sintomas gastrointestinais relacionados. O mesmo método foi aplicado em outro estudo prospectivo com 105 crianças com sintomas sugestivos da DRGE (4 meses a 12 anos de idade), mas neste caso, a pHmetria da hipofaringe não mostrou diferenças entre as crianças com e sem traçados de pHmetria anormais, independentemente delas apresentarem sintomas clínicos (149). Uma comparação cega de videomacrolaringoscopia, biópsias da laringe e do esôfago e pHmetria dual (do esôfago distal e hipofaringe) foi realizada em 39 crianças consecutivamente operadas para reconstrução das vias respiratórias. O pH da sonda superior não se correlacionou com qualquer um dos outros parâmetros avaliados (148). A definição de refluxo hipofaríngeo patológico é incerta, porque refluxo faringeano também ocorre em controles saudáveis e a quantidade de refluxo ácido que é necessária para causar patologia da laringe é desconhecida.
As mesmas dúvidas provavelmente também se aplicam à impedância intra-luminal de multicanais. Até o presente momento, dados normativos de diferentes faixas etárias pediátricas não estão disponíveis (151). Portanto, estudos adicionais criteriosamente controlados são necessários para definir qual a ferramenta diagnóstica irá melhor comprovar a DRGE extra-esofágica.
58. O diagnóstico de um evento agudo com risco de morte merece consideração de outras causas que não a DRGE.
Concordância: 100% (A+, 25%; A, 50%; A−, 25%; Grau: alto).
CONCLUSÕES
A presente iniciativa é o primeiro documento com representatividade internacional baseado em evidências para estabelecer uma definição formal da DRGE na população pediátrica. Uma iniciativa distinta constituída por uma Comissão mista das sociedades de gastroenterologia pediátricas européia (ESPGHAN) e norte-americana (NASPGHAN) está atualizando as normas que abordam as questões do diagnóstico e o manejo terapêutico relacionadas à DRGE.
Esta definição da DRGE na população pediátrica também destaca as semelhanças e as diferenças entre doenças relacionadas com o refluxo na faixa etária pediátrica e em adultos. Por exemplo, embora uma abordagem centrada no paciente para definir a DRGE seja razoável em adultos e em crianças escolares e adolescentes neurologicamente saudáveis, não houve consenso de que crianças abaixo dos 8 anos de idade possam comunicar com confiabilidade os sintomas relevantes. Dificuldades para a definição dos sintomas da DRGE para crianças pré-escolares e lactentes se devem a limitações de linguagem, a necessidade de que cuidadores façam os relatos dos sintomas e a eleição de um padrão-ouro para estabelecer o diagnóstico da DRGE. O presente documento também descreve as condições que colocam os pacientes pediátricos em risco maior de desenvolver a DRGE crônica e suas graves complicações. Estas condições incluem deficits neurológicos, atresia esofágica corrigida e fibrose cística, além de hérnia hiatal, obesidade e história familiar positiva para a DRGE ou suas complicações.
Historicamente, endoscopistas pediatras têm rotineiramente obtido biópsias do esôfago distal aparentemente normal e diagnosticado ou excluído a DRGE com base nos achados histológicos. Depois de revisar a literatura e de profundo debate entre os membros do grupo de consenso, alcançou-se um acordo de que parâmetros histológicos similares aos que são usados atualmente representam alterações reativas inespecíficas, as quais são insuficientemente sensíveis ou específicas para o diagnóstico da DRGE. O consenso alcançado foi que o valor da biópsia esofágica, na atualidade, é diagnosticar ou descartar outras condições, tais como, esofagite eosinofílica, esôfago de Barrett, infecção e doença de Crohn. O termo “metaplasia esofageana endoscopicamente suspeita” é proposto para conclusões endoscópicas consistentes com o esôfago de Barrett. Estas conclusões devem ser confirmadas por uma análise histologica criteriosa, e, a presença ou ausência de metaplasia intestinal específica deve ser explicitada. Esta é uma mudança significativa na abordagem diagnóstica e que está em conformidade com a definição de Montreal a respeito da DRGE em adultos.
Um esclarecimento também é oferecido sobre o estado atual das evidências a respeito de uma aparente associação entre a DRGE e uma variedade de sintomas extra-esofágicos. O consenso de Montreal incluiu declarações sobre a síndrome do refluxo com dor no peito, mas a raridade da doença isquêmica do coração em crianças fez com que esta afirmação fosse desnecessária para a definição da DRGE na população pediátrica.
Muitas áreas da DRGE em Pediatria se ressentem com a falta de testes de um suficiente alto nível de evidência. Estas incluem a necessidade da criação de escores de sintomas validados, evidência objetiva da DRGE para vários grupos etários, a caracterização da doença não-erosiva, incluindo o papel da histologia, estudos populacionais sobre os resultados em longo prazo das lesões esofágicas, e o papel do refluxo como causa de transtornos extra- esofágicos em pacientes pediátricos.
Estudos prospectivos, multicêntricos, com coleta uniforme, processamento e critérios de avaliação são extremamente necessários.
Pretendeu-se aqui que as definições da DRGE venham a proporcionar informações consistentes para sua utilização na prática clínica e para a elaboração de pesquisas nos diversos grupos etários pediátricos. As definições estabelecem padrões de referência para as agências de fomento, órgãos reguladores e indústria farmacêutica para que sejam empreendidos esforços para a realização de investigações relevantes.
CONFLITO DE INTERESSES
Responsável pelo artigo: Philip M. Sherman, MD.
Contribuições de autores específicos: Todos os autores participaram das reuniões de consenso e contribuíram com comentários gravados que comprovam as declarações. PMS escreveu uma primeira versão deste artigo com base nestas contribuições, que foi revisada por todos os autores e revista por PMS e EH Todos os autores aprovaram a versão final antes da apresentação.
Suporte financeiro: As reuniões foram organizadas e financiadas pela INSINC Consulting (Guelph, ON) com financiamento irrestrito da AstraZeneca Investigação e Desenvolvimento (M lndal ö, Suécia). O patrocinador não teve presença no desenvolvimento, conteúdo, comportamento e produção do manuscrito decorrentes das oficinas de trabalho.
Interesses concorrentes potenciais: UFN, SK, e CR não têm interesses financeiros significantes a relatar.
Conselho Consultivo:
Abbott (PMS, SK), AstraZeneca (SK), Mead Johnson (PMS), Movetis (SK, YV), Santarus (BDG). Consultor: Abbott (EH), Altana (EH), AstraZeneca (BDG, NV, SO), Axcan (BDG), Biocodex (YV), Braintree Labs (SO), Bristol Myers Squibb (SO), INSINC Consulting (PMS), Malesci (NV), McNeil (SO), Mead, Meridian (NV), Johnson and Johnson (SO), Novartis (NV), Orexo (NV), Proctor & Gamble (NV, PMS), Reliant (SO), Salix (SO), Santarus (BDG), Shire (NV), SHS (SK, YV), TAP (BDG, EH, SO, NV), Wyeth (BDG, SO).
Apoio à investigação: Altana (NV), AGI (NV), AstraZeneca (EH, SK, NV, YV), Boston Scientific (NV), Fresenius (SK), Institute Rosell (PMS), Medtronics (NV), Nestlé (SK, YV), Novartis (NV), Numico (YV), Shire (NV), SHS (SK, YV), TAP (BDG), Wyeth (YV). Speaker’s Bureau: AstraZeneca (BDG, SK, NV), Novartis (NV), Takeda (NV), TAP (BDG, NV). Stockholder: Antibe_therapeutics (PMS), Orexo (NV).
Outros: Nestlé Nutrition (PMS — educational program, YV).
AGRADECIMENTOS
Desejamos agradecer a cada um dos revisores ad hoc por sua colaboração e feedback de acordo com o desenvolvimento das afirmações e ao Sr. Paul Sinclair, INSINC Consulting Inc., por facilitar este processo e iniciativa.
Dra. Catherine Henderson prestou assistência editorial, preparando as atas das reuniões e gerenciando o banco de dados da literatura. PMS é recebedor de uma bolsa de investigação do Canadá para a doença gastrointestinal. BDG é financiado em parte por subvenções do NIH, DK-53708 e DK-06544.
Um agradecimento muito especial à Dra. Jacy C. Andrade por sua inestimável colaboração na elaboração deste documento na língua portuguesa.
GALERIA DE FOTOS
REFERÊNCIAS
1. Vakil N, van Zanten SV, Kahrilas P et al. The Montreal definition and classifi cation of gastroesophageal reflux disease: a global evidence-based consensus. Am J Gastroenterol 2006; 101: 1900 – 20.
2. Diaz DM, Winter HS, Colletti RB et al. Knowledge, attitudes and practice
styles of North American pediatricians regarding gastroesophageal reflux disease . J Pediatr Gastroenterol Nutr 2007; 45: 56 – 64.
3. Fried M, Quigley EM, Hunt RH et al. Are global guidelines desirable, feasible and necessary? Nat Clin Pract Gastroenterol Hepatol 2008; 5: 2 – 3.
4. Grade Working Group. Grading quality of evidence and strength of recommendations. BMJ 2004; 328: 1490 – 4.
5. Vakil N , Jones R , K ahrilas P et al. Imaginary drugs, imagined conflicts, and the conspiracy theory. Am J Gastroenterol 2007; 102: 461 – 2.
6. Stanford EA, Chambers CT, Craig KD . The role of developmental factors in predicting young children’s use of a self-report scale for pain. Pain 2006; 120: 16 – 23.
7. Von Baeyer CL, Spagrud LJ. Systematic review of observational (behavioral) measures of pain for children and adolescents aged 3 – 18 years. Pain 2007; 127: 140 – 50.
8. Kleinman L, Revicki DA, Flood E. Validation issues in questionnaires for diagnosis and monitoring of gastroesophageal reflux disease in children. Curr Gastroenterol Rep. 2006; 8: 230 – 6.
9. Deal L, Gold BD, Grems e DA e t al. Age-specific questionnaires distinguish
GERD symptom frequency and severity in infants and young children: development and initial validation. J Pediatr Gastroenterol Nutr. 2005; 41: 178– 85.
10. Gupta SK, Hassall E, Chiu Y-L et al. Presenting symptoms of nonerosive
and erosive esophagitis in pediatric patient. Dig Dis Sci 2006; 51: 858 – 63.
11. Gunasekaran TS, Dahlberg M, Ramesh P et al. Prevalence and associated
features of gastroesophageal reflux symptoms in a Caucasian-predominant adolescent school population. Dig Dis Sci 2008; 53: 2373 – 9.
12. Orenstein SR , Shalaby TM , Cohn JF. Reflux symptoms in 100 normal infants: diagnostic validity of the infant gastroesophageal reflux questionnaire. Clin Pediatr (Phila) 1996; 35: 607 – 14.
13. Orenstein SR, McGowan JD. Efficacy of conservative therapy as taught in the primary care setting for symptoms suggesting infant gastroesophageal reflux. J Pediatr 2008; 152: 310 – 4.
14. Orenstein SR, Hassall E, Furma ga-Jablonska W et al. Multicenter, double-blind, randomized, placebo-controlled trial assessing efficacy and safety of proton pump inhibitor lansoprazole in infants with symptoms of gastroesophageal reflux disease. J Pediatr 2009; PMID:19054529 (in press).
15. Ashorn M, Ruuska T, Karikoski R et al. The natural course of gastroesophageal reflux disease in children. Scand J Gastroenterol 2002; 37: 638 – 41.
16. Hassall E. Decisions in diagnosing and managing chronic gastroesophageal reflux disease in children. J Pediatr 2005; 146: S3 – S12.
17. Nelson SP, Chen EH, Syniar GM et al. Prevalence of symptoms of gastroesophageal reflux during infancy. A pediatric practice-based survey.
Pediatric Practice Research Group. Arch Pediatr Adolesc Med 1997; 151: 569 – 72.
18. Martin AJ, Pratt N, Kennedy JD et al. Natural history and familial relationships of infant spilling to 9 years of age. Pediatrics 2002; 109: 1061 – 7.
19. Miyazawa R, Tomomasa T, Kaneko H et al. Prevalence of gastro-esophageal reflux-related symptoms in Japanese infants. Pediatr Int 2002; 44: 513 – 6.
20. Barr RG. Crying behaviour and its importance for psychosocial development
in children. In: Tremblay RE, Barr RG, Peters RDeV (eds). Encyclopedia of Early Childhood Development. Centre for Excellence for Early Childhood Development: Montreal, Quebec, 2006, pp. 1 – 01.
21. St James-Roberts I, Halil T. Infant crying patterns in the first year: normal community and clinical findings. J Child Psychol Psychiatry 1991; 32: 951 –68.
22. Hassall E. Talk is cheap, often effective: symptoms in infants often respond to non-pharmacologic measures. J Pediatr 2008; 152: 301 – 3.
23. Orenstein SR, Hassall E. Infants and proton pump inhibitors: tribulations,
on trials . J Pediatr Gastroenterol Nutr 2007; 45: 395 – 8.
24. Shalaby TM, Orenstein SR. Efficacy of teaching of conservative therapy for infants with symptomatic gastroesophageal reflux referred by pediatricians gastroenterologists. J Pediatr 2003; 142:57-61.
25. Orenstein SR, Peters JM. Vomiting and regurgitation. In: Kleigman RM, Greenbaum LA, Lye PS (eds). Pratical Strategies in Pediatric Diagnosis and Therapy, 2nd edn. WB Saunders Company: Philadelphia, 2004.
26. Orenstein SR, Cohn JF, Shalaby TM et al. Realiability and validity of and infant gastroesophageal reflux questionnaire. Clin Pediatr (Phila) 1993; 32: 472-84.
27. Moore DJ, Tao BS, Lines DR et al. Double-blind placebo-controlled trial of omeprazole in irritable infants with gstroesophageal reflux. J Pediatr 2003; 143: 219-23.
28. Heine RG, Jordan B, Lubitz L et al. Clinical predictors of pathological gastro-esophageal reflux in infants with persistent distress. J Paediatr Child Health 2006; 42: 134-9.
29. Jordan B, Heine RG, Meehan M et al. Effect of antireflux medication, placebo and infant mental health intervention on persisten crying: a randomized clinical trial. J Paediatr Child Health 2006, 42: 49-58.
30. Kleinman L, Rothman M, Strauss R et al. The infant gastroesophageal reflux questionnaire revised: development and validation as an evaluative instrument. Clin Gastroenterol Hepatol 2006; 4: 588-96.
31. Salvatore S, Hauser B, Vandemaele K et al. Gastroesophageal reflux disease in infants: how much is predictable with questionnaires, pH-metry, endoscopy and histology? J. Pediatr Gastroenterol Nutr 2005; 40:210-5.
32. Hill DJ, Heine RG, Cameron DJ et al. Role of food protein intolerance in infants with persistent distress attributed to reflux esophagitis. J Pediatr 2000, 136:641-7.
33. Semeniuk J, Kaczmarski M. Gastroesophageal reflux in children and adolescents. Clinical aspects with special respect to food hypersensitivity. Adv Med Sci 2006; 51:327-35.
34. Nielsen RG, Bindslev-Jesen C, Kruse-Andersen S et al. Severe gastroesophageal reflux disease and cow milk hypersensitivity in infants and children: disease association and evaluation of a new challenge procedure. J Pediatr Gastroenterol Nutr 2004; 39: 383-91.
35. Iacono G, Carroccio A, Cavataio F et al. Gastroesophageal reflux and cow’s milk allergy in infants: a prospective study. J Allergy Clin Immunol 1996; 97:822-7.
36. Nelson SP, Chen EH Syniar GM et al. Prevalence of symptoms of Gastroesophageal reflux during childhood: a pediatric practice-based survey. Pediatric Practice Research Group. Arch Pediatr Adolesc Med 200;154:150-4.
37. Ruigomez A, Garcia Rodriguez LA, Wallander MA et al. Natural history of gastro-esophageal reflux disease diagnosed in general practice. Aliment Pharmacol Ther 2004;20:751-60.
38. Chitkara DK, Talley NJ, Weaver AL et al. Incidence o presentation of non functional gastrointestinal disorders in children from birth to 5 years: a cohort study. Clin Gastroenterol Hepatol 2007;5:186-91.
39. Hassal E. Co-morbidities in childhood Barret’s esophagus. J Pediatr Gastroenterol Nutr 1997;25:255-60.
40. Hassal E, Kerr W, El-Serag HG. Characteristics of children receiving proton pump inhibitors continuously for up to 11 years duration. J Pediatr 2007;150:262-7.
41. Vandenplas Y, Hassal E. Mechanisms of gastroesophageal reflux disease. J Pediatr Gastroenterol Nutr 2002;35:119-36.
42. Bohmer CJ, Klinkenberg-Knol EC, Niezen-de Boer MC et al. Gastroesophageal reflux disease in intellectually disabled individuals: how often, how serious, how manageable? Am J Gastroenterol 200; 95:1868-72.
43. Taylor ACF, Breen KJ Auldist A et al. Gastroesophageal reflux and related pathology in adults who were born with esophageal atresia: a long-term follow-up study. Clin Gastroenterol Hepatol 2007;5:702-6.
44. Koivusalo A, Pakarien MP, Rintala RJ. The cumulative incidence of significant gastroesophageal reflux in patients with oesophageal atresia with a distal fistula – a systematic clinical, pH-metric, and endoscopic follow-up study. J Pediatr Surg 2007;42:370-4.
45. Bagolan P, Iacobelli Bd B, De Angelis P et al. Long gap esophageal atresia and esophageal replacement: moving toward a separation? J Pediatr Surg 2004;39:1084-90.
46. Button BM, Roberts S, Kotsimbos TC et al. Gastroesophageal reflux (symptomatic and silent): a potentially significant problem in patients with cystic fibrosis before and after lung transplantation. J Heart Lung Transplant 2005;24:1522-9.
47. Romero Y, Cameron AJ, Schaid DJ et al. Barrett’s esophagus: prevalence in symptomatic relatives. Am J Gastroenterol 2002;97:1127-32.
48. Trudgill N. Familial factors in the etiology of Gastroesophageal reflux disease, Barrett’s esophagus, and esophageal adenocarcinoma. Chest Surg Clin N Am 2002;12:15-24.
49. El-Serag H. Role of obesity in GORD-related disorders. Gut 2008;57:281-4.
50. Gerson LB A little weight gain, how much Gastroesophageal reflux disease? Gastroenterology 2006;131:1644-6.
51. Hassall E. Israel D, Shepherd R el at. Omeprazole for treatment of chronic erosive esophagitis in children: a multicenter study of efficacy, safety, tolerability and dose requirements. International Pediatric Omeprazole Study Group. J Pediatr 2000;137:800-7.
52. Fiedorek S, Tolia V, Gold BD et al. Efficacy and safety of lansoprazole in adolescents with symptomatic erosive and non-erosive Gastroesophageal reflux disease. J Pediatr Gastroenterol Nutr 2005;40:319-27.
53. Ang D, Sifrim D, Tack J. Mechanisms of heartburn. Nat Clin Pract Gatroenterol Hepatol 2008;5:383-92.
54. Hoffman I, Tertychnyy A, Ectors N et al. Duodenogastro-esophageal reflux in children with refractory gastro-esophageal reflux disease. J Pediatr 2007;151:307-11.
55. Wu JC, Cheung CM, Wong VW et al. Distinct clinical characteristics between patients with nonerosive reflux disease and those with reflux esophagits. Clin Gastroenterol Hepatol 2007;5:690-5.
56. Furuta GT, Liacouras CA, Collins MH et al. Eosinophilic esophagitis in children and adults: a systematic revivew and consensus recommendations for diagnosis and treatment. Gastroenterology 2007;133:1342-63.
57. Fass R. Erosive esophagitis and nonerosive reflux disease (NERI): comparison of epidemiologic, physiologic, and therapeutic characteristics. J Clin Gastroenterol 2007;41:131-7.
58. Dent J, Brun J, Fendrick AM et al. An evidence-based appraisal of reflux disease management – the Genval Workshop report. Gut 1999;44(Suppl 2):S1-S16.
59. Tolia V, Ferry G, Gunasekaran T et al. Efficacy of lansoprazole in treatment of Gastroesophageal reflux disease in children. J Pediatr Gastroenterol Nutr 2002;35(Suppl 4):S308-18.
60. Kiesslich R, Kanzler S, Vieth M et al. Minimal change esophagitis: prospective comparison of endoscopic and histological and normal controls using magnifying endoscopy. Dig Dis 2004;22:221-7.
61. Gunnbjornsdottir MI, Omenaas E, Gislason T et al. Obesity and nocturnal gastro-esophageal reflux are related to onset of asthma and respiratory symptoms. Eur Respir J 2004;24:116-21.
62. Roland MM, Baran AS, Richert AC. Sleep-related laryngospasm caused by Gastroesophageal reflux. Sleep Med 2008;9:451-3.
63. Micthell RB, Call E, Kelly J. Ear, nose and throat disorders in children with Down syndrome. Laryngoscope 2003;113:259-63.
64. Kahn A, Rebuffat E, Sottianux M et al. Arousaks induced by proximal esophageal reflux in infants. Sleep 1991;14:39-42.
65. Gahem M, Armstrong KL, Trocki O et al. The sleep patterns of infants and young children with gastro-esophageal reflux. J Paediatr Child Health 1998;34:160-3.
66. Vandenplas Y, Deneyer M, Verlinden M et al. Gastroesophageal reflux incidence and respiratory dysfunction during sleep in infants: treatment with cisapride. J Pediatr Gastroenterol Nutr 198;8:31-6.
67. Turzikova J, Spicak V, Fuchs M ET AL. Exercise-induced Gastroesophageal reflux in nonasthmatic children. Allergy Clin Immunol Int 2001;13:49-53.
68. Rasquin A, Di Lorenzo C, Forbes D et al. Childhood functional gastrointestinal disorders: child/adolescent. Gastroenterology 2006;130:1527-37.
69. Chial HJ, Camilleri M, Williams DE et al. Rumination syndrome in children and adolescents: diagnosis, treatment, and prognosis. Pediatrics 2003;111:158-62.
70. Knan S, Hyman PE, Cocjin J et al. Rumination syndrome in adolescents. J Pediatr 2000;136:528-31.
71. Hyman PE, Milla PJ, Benninga MA et al. Childhood functional gastrointestinal disorders: neonate/toddler. Gastroenterology 2006;130:1519-26.
72. El-Serag, Bailey HB, Gilger M et al. Endoscopic manifestations of Gastroesophageal reflux disease in patients between 18 months and 25 years without neurological deficits. Am J Gastroenterol 2002;97:1635-39.
73. Dent J. Microscopic esophageal mucosal injury in nonerosive reflux disease. Clin Gastroentrol Hepatol 2007;5:4-16.
74. van Malestein H, Farre R, Sifrim D. Esophageal dilated intercellular spaces (DIS) and nonerosive reflux disease. Am J Gastroenterol 2008;103:1021-8.
75. Dahms BB. Reflux esophagitis: sequelae and differential diagnosis in infants and children including eosinophilic esophagitis. Pediatr Dev Pathol 2004;7:5-16.
76. Ismail-Beigi F, Horton PF, Pope CE II. Histological consequences of Gastroesophageal reflux in man. Gastroenterology 1970;58:163-74.
77. Weinstein WM, Bogoch ER, Bowes KL. The Normal Human esophageal mucosa: a histological reappraisal. Gastroenterology 1975;68:40-4.
78. Orenstein SR, Shalaby TM, Helsey SF et al. Natural history of infant reflux esophagitis: symptoms and morphometric histology during one year without pharmacotherapy. Am J Gastroenterol 2006;101:628-40.
79. Zentilin P. Savarino V, Mastracci L et al. Reassessment of the diagnostic value of histology in patients with GERD, using multiple biopsy sites and an appropriate control group. Am J Gastroenterol 2005;100:2299-306.
80. Sabri MT, Hussain SZ, Shalaby TM et al. Morphometric histology for infant gastroesophageal reflux disease: evaluation of reliability in 497 esophageal biopsies. J Pediatr Gastroenterol Nutr 2007;44:27-34.
81. DiGiorgio CJ, Orenstein SR, Shalaby TM et al. Quantitative computer-assisted image analysis of suction biopsy in pediatric Gastroesophageal reflux. Pediatr Pathol 1994;14:653-64.
82. Winter HS, Madara JL, Stafford RJ et al. Intraepithelial eosinophils: a new diagnostic criterion for reflux esophagitis. Gastroenterology 1982;83:818-23.
83. Spechler SJ, Genta RM, Souza RF. Thoughts on the complex relationship between Gastroesophageal, reflux disease and eosinophilic esophagitis. Am J Gastroenterol 2007;102:1301-6.
84. Heine RG, Cameron DJ, Chow CW et al. Esophagitis in distressed infants: poor diagnostic findings agreement between esophageal pH monitoring and histopathologic findings. J Pediatr 2002;140:14-9.
85. Nielsen RG, Fenger C, Bindslev-Jensen C et al. Eosinophilia in the upper gastrointestinal tract is not a characteristic feature in cow’s milk sensitive gastro-oesophageal reflux disease. Measurement by two methodologies. J Clin Pathol 2006;59:89-94.
86. Behar J, Sheahan D. Histologic abnormalities in reflux esophagitis. Arch Pathol 1975;99:387-91.
87. Biller JA, Winter HS, Grand RJ et al. Are endoscopic changes predictive of histologic esophagitis in children? J Pediatr 1983;103:215-8.
88. Black DD, Haggitt RC, Orentein SR et al. Esophagitis in infants Morphometric histological diagnosis and correlation with measures of gastroesophageal reflux. Gastroenterology 1990;98:1408-14.
89. Steiner SJ, Gupta SK, Croffie JM et al. Correlation between number of eosinophils and reflux index on same day esophageal biopsy and 24h esophageal pH monitoring. Am J Gastroenterol 2004;99:801-5.
90. Ravelli AM, Panarotto MB, Verdoni L et al. Pulmonary aspiration shown by scintigraphy in gastroesophageal reflux-related respiratory disease. Chest 2006; 130:1520-6.
91. Caviglia R, Ribolsi M, Maggiano N et al. Dilated intercellular spaces of esophageal epithelium in nonerosive reflux disease patients with physiological esophageal acid exposure. Am J Gastroenterol 2005;100:543-8.
92. Calabrese C, Bortolotti M, Fabri A et al. Reversibility of GERD ultrastructural alterations and relief of symptoms after omeprazole treatment. Am J Gastroenterol 2005;100:537-42.
93. Boccia G, Maguso F, Miele E at al. Maintenace therapy for erosive esophagitis in children after healing by omeprazole: is it advisable? Am J Gastroenterol 2007; 102:1291-7.
94. Hetzel DJ, Dent J, Reed WD et al. Healing and relapse of severe peptic esophagitis after treatment with omeprazole. Gastroenterology 1988;95:903-12.
95. Gunasekaran TS, Hassall EG. Efficacy and safety of omeprazole for severe Gastroesophageal reflux in children. J Pediatr 1993;123:148-54.
96. Lundell LR, Dent J, Bennett JR et al. Endoscopic assessment of oesophagitis: clinical and functional correlates and further validation of the Los Angeles classification. Gut 1999;45:172-80.
97. Dohil R, Hassall E. Esophageal stenosis in children. Gastrointest Endosc Clin N Am 1998;8:369-90.
98. Hassall E. Barrett’s esophagus: new definitions and approaches in children. J Pediatr Gastroenterol Nutr 1993;16:345-64.
99. Hassall E. Cardia-type mucosa as an esophageal metaplastic condition in children: Barrett’s esophagus, intestinal metaplasia-negative. J Pediatr Gastroenterol Nutr 2008;47:102-6.
100. Meining A, Ott R, Becker I et al. The Munich Barrett follow-up study: suspicion of Barrett’s oesophagus based on either endoscopy or history only-what is the clinical significance? Gut 2004;53:1402-7.
101. Ofman JJ, Shaheen NJ, Desai AA et al. The quality of care in Barrett’s esophagus: endoscopist and pathologist practices. Am J Gastroenterol 2001;96:876-81.
102. Cameron AJ. Barrett’s esophagus: prevalence and size of hiatal hernia. Am J Gastroenterol 1999;94:2054-9.
103. Hassall E. Endoscopy in children with GERD: “the way we were” and the way we should be. Am J Gastroenterol 2002;97:1583-6.
104. Weinstein WM, Ippoliti AF. The Diagnosis of Barrett’s esophagus: goblets, goblets, goblets. Gastrointest Endosc 1996;44:91-5.
105. Reid BJ, Blount PL, Feng Z et al. Optimizing endoscopic biopsy detection of early cancers in Barrett’s high-grade dysplasia. Am J Gastroenterol 2000;95:3089-96.
106. Chandrasoma PT, Der R, Dalton P et al. Distribution and significance of epithelial types in columnar-lined esophagus. Am J Surg Pathol 2001;25:1188-93.
107. Qualman SJ, Murray RD, McClung HJ et al. Intestinal metaplasia is age related in Barrett’s esophagus. Arch Pathol Lab Med 1990;114:1236-40.
108. Haggitt RC. Barrett’s esophagus, dysplasia, and adenocarcinoma. Hum Pathol 1994;25:982-93.
109. Sharma P, McQuaid K, Dent J et al. A critical review of the diagnosis and management of Barrett’s esophagus: the AGA Chicago Workshop. Gastroenterology 2004;127:310-30.
110. Byrne JP, Bhatnagar S, Hamid B et al. Comparative study of intestinal metaplasia and mucin staining at the cardia and esophagogastric junction in 225 symptomatic patients presenting for diagnostic open-access gastroscopy. Am J Gastroenterol 1999;94:98-103.
111. Peitz U, Vieth M, Pross M et al. Cardia-Type metaplasia arising in the remnant esophagus after cardia resection. Gastrointest Endosc 2004;59:810-7.
112. MacNeil-Covin L, Casson AG, Malatialian D et al. A survey of Canadian gastroenterologists about the management of Barrett’s esophagus. Can J Gastroenterol 2003;17:313-7.
113. Kinbourne M. Hiatus hernia with contortions of the neck. Lancet 1964;13:1058-61.
114. Cerimagic D, Ivkic G, Bilic E. Neuroanatomical basis of Sandifer’s syndrome: a new vagal reflex? Med Hypotheses 2008;70:957-61.
115. El-Serag HB, Gilger M, Kuebeler M et al. Extraesophageal associations of Gastroesophageal reflux disease in children without neurologic defects. Gastroenterology 2001;121:1294-9.
116. Tasker A, Dettmar PW, Panetti M et al. Reflux of gastric juice and glue ear in children. Lancet 2002;359:493.
117. Crapko M, Kerschener JE, Syring M et al. Role of extra-esophageal reflux in chronic otitis media with effusion. Laryngoscope 2007;117:1419-23.
118. Havemann B, Henderson CA, El-Serag HB. The association between Gastroesophageal reflux disease and asthma: a systematic review. Gut 2007;56:1654-64.
119. Debley JS, Carter ER, Redding GJ. Prevalence and impact of Gastroesophageal reflux in adolescents with asthma: a population-basead study. Pediatr Pulmonol 2006;41:475-81.
120. Stordal K, Johannesdottir GB, Bentsen BS et at. Asthma and overweight are associated with symptoms of gastro-oesophageal reflux. Acta Paediatr 2006;95:1197-201.
121. Hancox RJ, Poulton R, Taylor DR et al. Associations between respiratory symptoms, lung function and gastro-oesophageal reflux symptoms in a population-based birth cohort. Respir 2006;7:142-50.
122. Kiljander TO, Harding SM, Field SK et al. Effetcs of esomeprazole 40mg twice daily on asthma: a randomized placebo-controlled trial. Am J Respir Crit Care Med 2006;173:1091-7.
123. Littner MR, Leung FW, Ballard ED II et al. Effects of 24 weeks of lansoprazole therapy and asthma sumptoms, exacerbations, quality of life, and pulmonary function in adult asthma patients with acid reflux symptoms. Chest 2005;128:1128-35.
124. Stordal K, Johannesdottir GB, Bentsen BS et al. Acid suppression does not change respiratory symptoms in children with asthma and gastro-oesophageal reflux disease. Arch Dis Child 2005;90:956-60.
125. Khoshoo V, Haydel R Jr. Effect of antireflux treatment on asthma exacerbations in nonatopic children. J Pediatr Gastroenterol Nutr 2007;44:331-5.
126. Block BB, Brodsky L. Hoarseness in children: the role of laryngopharyngeal reflux. Int J Pediatr Otorhinolaryngol 2007;71:1361-9.
127. Mitzner R, Brodsky L. Multilevel esophageal biopsy in children with airway manifestations of extraesophageal reflux disease. Ann Otol Rhinol Laryngol 2007;116:571-5.
128. Hicks DM, Ours TM, Abelson TI et al. The prevalence of hypopharynx findings associated with Gastroesophageal reflux in normal volunteers. J Voice 2002;16:564-79.
129. Branski RC, Bhattacharyya N, Shapiro J. The reliability of the assessment of endoscopic laryngeal findings associated with laryngopharyngeal reflux disease. Laryngoscope 2002;112:1019-24.
130. Qadder MA, Phillips CO, Lopez AR et al. Proton pump inhibitor therapy for suspected GERD-related chronic laryngitis: a meta-analysis of randomized controlled trials. Am J Gastroenterol 2006;101:2646-54.
131. Gatta L, Vaira D, Sorrenti G ate al. Meta-analysis: the efficacy of proton pump reflux inhibitors for laryngeal symptoms attributed to gastroesophageal reflux disease. Aliment Pharmacol Ther 2007;25:385-92.
132. Vaezi MF, Ricther JE, Stasney CR et al. Treatment of chronic posterior laryngitis with esomeprazole. Laryngoscope 2006;116:254-60.
133. Chang AB, Lasserson TJ, Gaffney J et al. Gastro-oesophageal reflux treatment for prolonged non-specific cough in children and adults. Cochrane Database Syst Rev 2006; October 18;4:CD004823.
134. Linnett V, Seow WK, Connor F et al. Oral health od children with gastro-esophageal reflux disease: a controlled study. Aust Dent J 2002;47:156-62.
135. Ersin NK, Oncag O, Tumgor G et al. Oral and dental manifestations of Gastroesophageal reflux disease in children: a preliminary study. Pediatr Dent 2006; 28:279-84.
136. Dahshan A, Pater H, Delaney J et al. Gastroesophageal reflux disease and dental erosion in children. J Pediatr 2002;140:474-8.
137. Jensdottir T, Arnadottir IB, Thorsdottir I et al. Relationship between dental erosion, soft drink consumption, and Gastroesophageal reflux among Icelanders. Clin Oral Investig 2004;8:91-6.
138. Pace F, Pallotta S, Tonini M et al. Systematic review: gastro-oesophageal reflux disease and dental lesions. Aliment Pharmacol Ther 2008;27:1179-86.
139. Hrabovsky EE, Mullett MD. Gastroesophageal reflux and the premature infant. J Pediatr Surg 1986;21:583-7.
140. Radford PJ, Stillwell PC, Blue B et al. Aspiration complication bronchopulmonary dysplasia. Chest 1995;107:185-8.
141. Akinola E, Rosenkrantz TS, Papagallo M et al. Gastroesophageal reflux in infants <32 weeks gestational age at birth: lack of relationship to chronic lung disease. Am J Perinatol 2004;21:57-62.
142. Bhat RY, Rafferty GF, Hannam S et al. Acid Gastroesophageal reflux in convalescent preterm infants: effect of posture and relationship to apnea. Pediatr Res 2007;62:620-3.
143. Thach BT. Maturation of cough and other reflexes that protect the fetal and neonatal airway. Pulm Pharmacol Ther 2007;20:365-70.
144. Molloy EJ, Di Fiore JM, Martin RJ. Does Gastroesophageal reflux cause apnea in preterm infants? Biol Neonate 2005;87:254-61.
145. Poets CF. Gastroesophageal reflux: a critical review of its role in preterm infants. Pediatrics 2004;113:128-32.
146. McGovern MC, Smith MB. Causes of apparent life threatening events in infants. A systematic review. Arch Dis Child 2004;89:1043-8.
147. Semeiuk J, Kaczmarski M, Wasilewska J et al. Is acid Gastroesophageal reflux in children with ALTE etiopathogenetic factor of life threatening symptom? Adv Med Sci 2007;52:213-21.
148. McMurray JS, Geber M, Stern Y et al. Role laryngoscopy, dual pH probe monitoring, and laryngeal mucosal biopsy in the diagnosis of pharyngoesophageal reflux. Ann Otol Rhinol Laryngol 2001;110:299-304.
149. Ramaiah RN, Stevenson M, McCallion WA. Hypopharyngeal and distal esophageal pH monitoring in children with Gastroesophageal reflux and respiratory symptoms. J Pediatr Surg 2005;40:1557-61.
150. Little JP, Mattews BL, Glock MS et al. Extraesophageal pediatric reflux: 24-h double-probe pH monitorinh of 222 children. Ann Otol Rhinol Laryngol Suppl 1997;169:1-16.
151. Nurko S, Rosen R. Use of multi-channel intraluminal impedance (MII) in the evaluation of children with respiratory symptoms: a new phenomenon? J Pediatr Gastroenterol Nutr 2005;41:166-8.