Gastrite hemorrágica por Alergia ao Leite de Vaca: Relato de dois casos
Rodrigo Strehl Machado1, Elisabete Kawakami2, Soraya Goshima1, Francy Reis Patrício3, Ulysses Fagundes Neto4
1. Médico Pediatra, Mestre em Medicina pela Universidade Federal de São Paulo, Escola Paulista de Medicina.
2. Professora de Gastroenterologia Pediátrica, Departamento de Pediatria, Universidade Federal de São Paulo, Escola Paulista de Medicina.
3. Professora de Patologia, Departamento de Patologia, Universidade Federal de São Paulo, Escola Paulista de Medicina.
4. Professor Titular da Disciplina de Gastroenterologia Pediátrica, Departa mento de Pediatria, Universidade Federal de São Paulo, Escola Paulista de Medicina.
J Pediatr (Rio J) 2003;79(4):363-8: gastrite hemorrágica, alergia ao leite de vaca, lactentes.
Resumo
Objetivo: descrever dois lactentes com gastrite hemorrágica, devido à alergia ao leite de vaca.
Descrição dos casos: ambos os pacientes apresentavam hematêmese, vômitos e desnutrição. Os pacientes apresentavam infiltrado eosinofílico em mucosa gástrica biopsiada e resolução dos sintomas após o início de dieta com exclusão da proteína do leite de vaca.
Comentários: gastrite hemorrágica devido à alergia ao leite de vaca é um diagnóstico incomum. Até o momento foram relatados 10 pacientes com gastrite alérgica, e as principais manifestações clínicas são vômitos, desnutrição, anemia e hematêmese. A gastrite por alergia ao leite de vaca pode apresentar-se em diferentes graus de gravidade, e pode ser subdiagnosticada em muitos pacientes. A menos que o tratamento correto seja iniciado, o paciente desenvolverá desnutrição proteico-calórica grave e anemia. Doença alérgica do trato gastrointestinal superior deve ser considerada em todos os lactentes com vômitos recorrentes, particularmente se complicado com hematêmese. O diagnóstico de gastrite alérgica é clínico, auxiliado pela endoscopia e anatomia patológica.
As manifestações gastrointestinais de alergia alimentar incluem diarreia crônica com má absorção, sangramento retal, refluxo gastroesofágico, constipação intestinal e hemorragia digestiva alta1-4. Refluxo gastroesofágico (RGE) e alergia ao leite de vaca (ALV) são considerados os distúrbios gastrointestinais mais comuns em lactentes no primeiro ano de vida, e, muitas vezes, são patologias relacionadas3,5. Vômitos persistentes, ganho ponderal insuficiente e hematêmese, em lactentes jovens, podem ser decorrentes a RGE secundário à gastrite por ALV, manifestação pouco frequente desta patologia6-10. Neste estudo, relatamos dois pacientes atendidos em nosso serviço, ao longo destes últimos seis anos, com gastrite hemorrágica.
Descrição de casos
Caso 1
T.A.S.S., sexo masculino, 24 meses, nascido a termo, sem intercorrências perinatais, com queixa de vômitos, hematêmese e perda de peso. Referia regurgitações frequentes desde os dois meses, e, aos cinco meses, foi internado em outro hospital, devido a dois episódios de hematêmese acompanhados de palidez e irritabilidade. A partir do segundo dia de internação, as fezes tornaram-se diarreicas, sem sangue, mas apresentou melhora clínica, realizou endoscopia digestiva ao nono dia de internação, que foi relatada como exame normal; não necessitou de transfusão sanguínea e teve alta hospitalar. Manteve quadro de irritabilidade e vômitos, perdendo peso, e, após 45 dias, apresentou outro episódio de hematêmese. Não havia febre ou alterações cutâneas. Nessa ocasião, procurou nosso serviço. Exames: hemoglobina 10,2 g/dl, hematócrito 32%,
15.600 leucócitos (neutrófilos bastonetes 8%, neutrófilos segmentados 47%, eosinófilos 3%, linfócitos 36% e monócitos 6%); os testes de coagulação apresentaram-se normais. A endoscopia digestiva alta mostrou pangastrite ero siva hemorrágica, que foi atribuída à ingestão de ácido acetilsalicílico, pois a mãe administrava regularmente (50mg/dia) para debelar cólicas. Foi prescrito ranitidina, sulfato ferroso e recomendou-se a interrupção do uso de ácido acetilsalicílico e outros antiinflamatórios não-este róides (AINE). Após 15 dias, retornou referindo vários episódios de vômitos com sangue. Na ocasião, o paciente apresentava escores z de peso para idade e estatura para a idade inferiores a -2. Exame endoscópico mostrou pangas trite erosiva hemorrágica. Biópsia de antro mostrou gastrite aguda ulcerada com intenso infiltrado eosinofílico (24,1 eosinófilos /campo de grande aumento), negativo para Helicobacter pylori; biópsia de duodeno mostrou enteropa tia com atrofia vilositária subtotal, e biópsia retal mostrou colite crônica inespecífica, sem infiltrado de eosinófilos. Aos 10 meses de vida, pesava 8.500 g e media 71 cm (escores z de peso para a idade e de estatura para a idade superiores a -1,5). A introdução de fórmula láctea ocorreu aos dois meses de idade. Não havia história familiar de alergia.
Diagnosticou-se ALV e iniciou-se dieta com exclusão da proteína do leite de vaca da dieta e introduziu-se fórmula a base de soja. Evoluiu com remissão total dos sintomas; houve recuperação nutricional e normalização dos níveis de hemoglobina. Aos dois anos de idade, foi realizada nova endoscopia e, durante o procedimento, foi infundido leite de vaca diretamente sobre a mucosa gástrica, sendo coletada biópsia gástrica neste local. Não houve alteração macroscópica e a histologia foi normal. Reintroduziu-se leite de vaca, permanecendo assintomático, com boa evolução ponderal e, após dois anos de seguimento, teve alta assintomático.
Caso 2
B.S.S., sexo feminino, 24 meses, encaminhada com queixa de vômitos pós-alimentares e ganho de peso insuficiente. O quadro iniciou aos dois meses de idade, com vômitos diários, com traços de sangue, duas a três vezes por semana e, em três ocasiões, referia maior quantidade de sangue. Aos três meses, diagnosticou-se RGE, recebendo tratamento com cisaprida e ranitidina. Após dez dias de tratamento, os vômitos com sangue persistiram, iniciando quadro diarreico, com comprometimento do estado geral, sendo internada em nosso serviço. Hemocultura foi positiva para Escherichia coli e iniciou-se ceftriaxone. A paciente apresentava também anemia (hemoglobina 6,2 g/l), reque rendo duas transfusões sanguíneas. Pesava 5.300 g e media 57,5 cm aos cinco meses de idade (escores z de peso para idade e estatura para a idade inferiores a -2).
A paciente nasceu a termo e apresentou icterícia neona tal, requerendo fototerapia, sem outras intercorrências. O leite de vaca integral foi introduzido no primeiro mês de vida. Não havia história familiar de atopia.
Exame endoscópico mostrou esofagite, gastrite erosiva no cárdia e na parede anterior de corpo e duodenite, sendo coletados fragmentos de esôfago, estômago e duodeno. À histologia, a mucosa esofágica mostrou congestão vascular e alguns leucócitos intra-epiteliais, a mucosa gástrica apresentava área de erosão superficial, edema, congestão vascu lar, infiltrado inflamatório denso e difuso, com a presença de linfócitos, plasmócitos, neutrófilos e numerosos eosinófilos (26,2 /campo de grande aumento) no epitélio glandu lar, no fundo das criptas e na muscularis mucosae. Também foram observados organismos similares ao Helicobacter pylori. A mucosa duodenal exibia aumento da celularidade do córion, leve eosinofilia e áreas de discreto achatamento das vilosidades. Foi coletada também biópsia de mucosa retal, que apresentava discreto aumento do infiltrado celu lar do córion.
Excluíram-se derivados lácteos da dieta, houve resolu ção total dos sintomas e alcançou recuperação nutricional, em uso de fórmula semi-elementar. Aos dois anos de idade, foi feito desencadeamento com fórmula láctea, e a paciente permaneceu assintomática.
Comentários
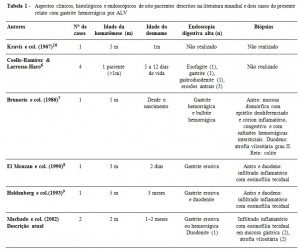
Hemorragia digestiva alta é sintoma pouco frequente em lactentes, e pode estar associada à esofagite de refluxo, gastrite por AINE, gastrite por estresse, úlcera gástrica primária e gastrite secundária à ALV. Foi descrita inicialmente por Kravis e col.10, que relatou um paciente de três meses de idade com vômitos, hematêmese e baixo ganho de peso, que desapareceram após a exclusão da proteína do leite de vaca da dieta. Há outros quatro relatos na literatura, envolvendo mais sete pacientes6-10 (Tabela 1).
Em todos os pacientes descritos, houve desmame preco ce, nos três primeiros meses de vida, e início do quadro clínico no primeiro semestre de vida (um com hematêmese no primeiro mês). Embora alguns casos de gastrite alérgica tenham início abrupto, muitos pacientes relatados passam um período com sintomas sugestivos de refluxo, com vômi tos persistentes, como observado nos dois pacientes descri tos. O sintoma mais frequente foi vômitos recorrentes, culminando, na maioria deles (7/9 pacientes), com episódi os de hematêmese. Vale salientar que 22% (2/9) dos paci entes não apresentaram hemorragia digestiva alta em momento algum de sua evolução. Portanto, lactentes com RGE refratário ao tratamento clínico podem apresentar refluxo secundário à ALV. As diretrizes da Sociedade Norteamericana de Gastroenterologia, Hepatologia e Nutrição Pediátrica incluíram dieta hipoalergênica (ensaio por uma semana) no algoritmo de manejo do lactente com RGE3,11.
Uso de anti-inflamatório não-esteróide (AINE) deve ser sempre considerado na ocorrência de hemorragia digestiva alta, posto que a indicação de AINE é muito difundida no tratamento das infecções virais respiratórias em nosso meio. Tais medicações são muito tóxicas à mucosa gástrica, e estudos experimentais demonstram que dez minutos após exposição direta ao ácido acetilsalicílico, a mucosa apresenta alterações ultra-estruturais decorrentes de sua toxicidade12. Os achados histológicos são variados, desde hiperplasia foveolar, edema, proliferação de músculo liso na camada muscular da mucosa, números normais ou levemente aumentados de células linfomononucleares e ausência de leucócitos polimorfonucleares, salvo se há erosão na área biopsiada. Por outro lado, na gastrite alérgica ocorre um aumento do infiltrado linfoplasmocitário e infiltrado neutrofílico com eosinofilia tecidual13. A resposta ao tratamento contribui para o diagnóstico diferencial, pois a hemorragia cessa logo após a suspensão do medicamento causador da gastrite medicamentosa.
Anormalidades endoscópicas, especialmente esofagite, erosões gástricas, erosões duodenais e hiperplasia nodular linfóide no duodeno são frequentes em pacientes com alergia alimentar, e provavelmente são subdiagnostica das14. Erosões gástricas estavam presentes em 3/15 pacien tes com dor abdominal e diarreia, com diagnóstico de alergia alimentar estabelecido com desencadeamento duplo-cego placebo controlado, embora nenhum deles tivesse apresentado hemorragia digestiva15. A região do antro gástrico sempre apresenta padrão inflamatório com eosino filia tecidual, enquanto no corpo gástrico as alterações são focais16. Eosinofilia na mucosa gástrica (região gástrica biopsiada não especificada) foi descrita em 16/28 pacientes por Kokkonen e col. 14, contra 1/56 dos controles, enquanto eosinofilia no intestino proximal foi similar nos dois grupos de pacientes. A eosinofilia da mucosa gástrica, importante ao diagnóstico, pode estar presente também em processos neoplásicos, pólipo fibróide inflamatório, doença de Crohn, poliarterite nodosa, infestações parasitárias, gastrite granulomatosa, edema hereditário angioneurótico, masto citose sistêmica, síndrome de hipereosinofilia, histiocitose X, e gastroenterite eosinofílica, diagnósticos pouco prová veis no primeiro semestre da vida17.
Má absorção é frequente na APLV, e em uma casuística italiana com 73 pacientes, os sintomas mais frequentes foram diarreia (44/73, 60,3%) e retardo do crescimento (24/73, 32,9%)18. Nos casos descritos de gastrite alérgica (Tabela 1), diarreia (quatro pacientes) e ganho ponderal insuficiente (sete pacientes) foram sintomas comuns, indicando geralmente acometimento conjunto do intestino delgado em uma parcela dos pacientes. Mesmo nos pacientes com sintomas de gastrite iniciados de forma abrupta, foi observado retardo ponderal, sugerindo que já havia má-absorção. Todos os pacientes relatados por Coello-Ramirez e Larrosa-Haro apresentavam teste de absorção de D xilose anormal6. Nossos dois pacientes apresentaram atrofia vilositária, um deles subtotal em biópsias de duodeno associada a infiltrado linfoplasmocitário, e alterações similares foram também descritas por Brunerie e col.7 Portanto, comprometimento do intestino delgado é frequente e justifica o agravo nutricional encontrado entre os casos relatados.
Descrita inicialmente por Gryboski e col., a colite alérgica é uma manifestação comum de ALV, com quadro clínico típico e ocorre principalmente em lactentes jovens2,10,19. A colite alérgica pode ocorrer com estímulo antigênico veiculado pelo leite materno, mesmo em pacien tes ainda não expostos diretamente a proteínas heterólogas20,21. O diagnóstico é auxiliado pelo exame histológico,em que há infiltrado de linfomononucleares e eosinófilos na mucosa retal22,23.
Nossos pacientes não apresentavam co lite alérgica, ao contrário da paciente descrita por Brunerie e col.7 Os pacientes com colite alérgica geralmente têm acometimento basicamente do intestino grosso, sem reper cussão no estado nutricional, e são lactentes com aspecto saudável. Constipação intestinal pode ser uma manifesta ção de alergia alimentar, possivelmente pela dor evacuatória associada à inflamação do reto4.
Os mecanismos imunológicos envolvidos na enteroco lite alérgica não estão bem definidos24. A alergia a antíge nos presentes no alimento pode ser resultado de alterações na função linfocitária25. O leite de vaca é rico em determi nantes antigênicos, sendo a beta-lactoglobulina a mais importante, a qual pode ser reconhecida pelas células T de pacientes alérgicos em uma variedade de epitopos26. O estímulo de células T por mitógenos de pacientes com alergia alimentar produz menos interferon que o estímulo de linfócitos T oriundos de indivíduos normais27. Na mucosa intestinal, há também aumento na quantidade de linfóci tos gama delta, assim como na relação / CD315. A maior permeabilidade da mucosa intestinal a macromoléculas nos primeiros meses de vida atua como um precipitante em pacientes com desmame precoce. A normalização das alte rações linfocitárias marca o desenvolvimento de tolerância, geralmente no fim do primeiro ano de vida28-30.
O diagnóstico de alergia alimentar classicamente é estabelecido pelo critério de Goldman, ou seja, a resolução dos sintomas sob dieta de exclusão e a recaída com o desencadeamento com o antígeno31,32. Isto pode não ser adequado em lactentes, pois o desenvolvimento de tolerân cia pode levar a um desencadeamento negativo, e um desencadeamento precoce pode não ser recomendado pela potencial gravidade das manifestações32. Outros exames, como a pesquisa de imunoglobulina E específica, através de exames sorológicos ou de testes cutâneos, não são suficien temente sensíveis entre lactentes e não são recomendados32. A infusão de leite sobre a mucosa gástrica durante endoscopia pode produzir lesão macro e microscópica em curto espaço de tempo em pacientes adultos sensibilizados, mas não há estudos em crianças33.
É importante observar que a única contribuição do hemograma é a presença de anemia microcítica. Ao contrá rio da colite alérgica, em que até 40% dos pacientes apresentam eosinofilia importante, tal alteração não foi obser vada em nenhum dos pacientes relatados com gastrite alérgica6-10,16.
A exclusão da proteína do leite de vaca produz resposta clínica importante. A dieta recomendada deve ser isenta em leite de vaca e seus derivados, e fórmulas para lactentes, compostas por hidrolisado proteico ou proteína de soja, podem ser empregadas. A maioria dos relatos na literatura refere emprego de fórmula à base de proteína da soja com sucesso, mas 40% dos pacientes podem apresentar sensibi lidade cruzada34. Entre os relatos disponíveis, em apenas dois pacientes a fórmula empregada continha hidrolisado proteico, embora constitua a alternativa preferencialmente empregada, se disponível20,21.
A ALV compromete a mucosa gástrica em graus variá veis, desde gastrite histológica a gastrite hemorrágica, sua expressão máxima de gravidade, podendo ser subdiagnos ticada. A gastrite por ALV pode estar presente em lactentes com sintomas como vômitos, irritabilidade, falha em ganhar peso, mesmo na ausência de hemorragia digestiva aparente. O diagnóstico é eminentemente clínico, e o tratamento deve ser rapidamente instituído, em casos suspeitos. A endoscopia digestiva alta com biópsias deverá ser realizada, se a evolução não confirmar o diagnóstico.
Referências bibliográficas
1. Sampson HA. Food allergy. Part 1: immunopathogenesis and clinical disorders. J Allergy Clin Immunol 1999;103:717-28.
2. Fagundes Neto U, Martins MCV, Lima FMLS. Intolerância às proteínas heterólogas da dieta: enteropatia às proteínas do leite de vaca, soja e frango e suas manifestações clínicas. J Pediatr (Rio J) 1988;64:306-10.
3. Cavataio F, Iacono G, Montalto G, Soresi M, Tumminello M, Campagna P, et al. Gastroesophageal reflux associated with cow’s milk allergy in infants: which diagnostic examinations are useful? Am J Gastroenterol 1996;91:1215-20.
4. Iacono G, Cavataio F, Montalto G, Florena A, Tumminello M, Soresi M, et al. Intolerance of cow’s milk and chronic constipation in children. N Engl J Med 1998;339:1100-4.
5. Cavataio F, Carroccio A, Iacono G. Milk-induced reflux in infants less than one year of age. J Pediatr Gastroenterol Nutr 2000;30 Suppl:36-44.
6. Coello-Ramirez P, Larrosa-Haro A. Gastrointestinal occult hemorrhage and gastroduodenitis in cow’s milk protein intolerance. J Pediatr Gastroenterol Nutr 1984;3:215-8.
7. Brunerie M, Olives JP, Couvaras O, Ghisolfi J. Gastroduodénite aiguë hémorragique par intolérance aux protéines du lait de vache. Arch Fr Pediatr 1986;43:291.
8. el Mouzan MI, al Quorain AA, Anim JT. Cow’s-milk-induced erosive gastritis in an infant. J Pediatr Gastroenterol Nutr 1990;10:111-3.
9. Heldenberg D, Abudy Z, Keren S, Auslaender L. Cow’s milkinduced hematemesis in an infant. J Pediatr Gastroenterol Nutr 1993;17:450-2.
10. Kravis LP, Donsky G, Lecks HI. Upper and lower gastrointestinal tract bleeding induced by whole cow’s milk in an atopic infant. Pediatrics 1967;40:661-5.
11. Rudolph CD, Mazur LJ, Liptak GS, Baker RD, Boyle JT, Colletti RB, et al. Guidelines for evaluation and treatment of gastroesophageal reflux in infants and children: recommendations of the North American Society for Pediatric Gastroenterology and Nutrition. J Pediatr Gastroenterol Nutr 2001;32 Supl 2:1-31.
12. Baskin WN, Ivey KJ, Krause WJ, Jeffrey GE, Gemmell RT. Aspirin-induced ultrastructural changes in human gastric mucosa: correlation with potential difference. Ann Intern Med 1976;85:299-303.
13. Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994. Am J Surg Pathol 1996;20:1161-81.
14. Kokkonen J, Ruuska T, Karttunen TJ, Niinimaki A. Mucosal pathology of the foregut associated with food allergy and recurrent abdominal pains in children. Acta Paediatr 2001;90:16-21.
15. Kokkonen J, Haapalahti M, Laurila K, Karttunen TJ, Maki M. Cow’s milk protein-sensitive enteropathy at school age. J Pediatr 2001;139:797-803.
16. Goldman H, Proujansky R. Allergic proctitis and gastroenteritis in children. Clinical and mucosal biopsy features in 53 cases. Am J Surg Pathol 1986;10:75-86.
17. Villanacci V, Ragni F, Grigolato PG, Favret M, Marocolo D, Benetti A, et al. Gastrite eosinofila. Considerazioni clinicopatologiche su di un caso e revisione della letteratura. Minerva Med 1990;81:735-40.
18. Mancini S, Castro M, Lucidi V, Palumbo M, Dall’Oglio L. Caratteristiche cliniche in 73 bambini affetti da allergia alle proteine del lette vaccino. Minerva Pediatr 1985;37:49-52.
19. Gryboski JD, Burkle F, Hillman R. Milk induced colitis in an infant. Pediatrics 1966;38:299-302.
20. Machida HM, Catto Smith AG, Gall DG, Trevenen C, Scott RB. Allergic colitis in infancy: clinical and pathologic aspects. J Pediatr Gastroenterol Nutr 1994;19:22-6.
21. Odze RD, Wershil BK, Leichtner AM, Antonioli DA. Allergic colitis in infants. J Pediatr 1995;126:163-70.
22. Iyngkaran N, Yadav M, Boey CG. Rectal mucosa in cows’ milk allergy. Arch Dis Child 1989;64:1256-60.
23. Berezin S, Schwarz SM, Glassman M, Davidian M, Newman LJ. Gastrointestinal milk intolerance of infancy. Am J Dis Child 1989;143:361-2.
24. Walker WA. Cow’s milk protein-sensitive enteropathy at school age: a new entity or a spectrum of mucosal immune responses with age. J Pediatr 2001;139:765-6.
25. Guarderas JC. Is it food allergy? Differentiating the causes of adverse reactions to food. Postgrad Med 2001;109:125-7, 131-4.
26. Inoue R, Matsushita S, Kaneko H, Shinoda S, Sakaguchi H, Nishimura Y, et al. Identification of beta-lactoglobulin-derived peptides and class II HLA molecules recognized by T cells from patients with milk allergy. Clin Exp Allergy 2001;31:1126-34.
27. Jaffe JS, James SP, Mullins GE, Braun-Elwert L, Lubensky I, Metcalfe DD. Evidence for an abnormal profile of interleukin-4 (IL-4), IL-5, and gamma-interferon (gamma-IFN) in peripheral blood T cells from patients with allergic eosinophilic gastroenteritis. J Clin Immunol 1994;14:299-309.
28. Suomalainen H, Soppi E, Laine S, Isolauri E. Immunologic disturbances in cow’s milk allergy, II: Evidence for defective interferon-gamma generation. Pediatr Allergy Immunol 1993;4:203-7.
29. Nagata S, Yamashiro Y, Ohtsuka Y, Shioya T, Oguchi S, Shimizu T, et al. Quantitative analysis and immunohistochemical studies on small intestinal mucosa of food-sensitive enteropathy. J Pediatr Gastroenterol Nutr 1995;20:44-8.
30. Augustin M, Karttunen TJ, Kokkonen J. TIA1 and mast cell tryptase in food allergy of children: increase of intraepithelial lymphocytes expressing TIA1 associates with allergy. J Pediatr Gastroenterol Nutr 2001;32:11-8.
31. Goldman AS, Anderson Jr. DW, Sellers WA, Saperstein S, Knicker WT, Halpern SR. Milk allergy I. Oral challenge with milk and isolated milk proteins in allergic children. Pediatrics 1963;32:425-43.
32. Diagnostic criteria for food allergy with predominantly intestinal symptoms. The European Society for Paediatric Gastroenterology and Nutrition Working Group for the Diagnostic Criteria for Food Allergy. J Pediatr Gastroenterol Nutr 1992;14:108-12.
33. Reimarm HJ, Levvin J. Gastric mucosal reactions in patients with food allergy. Am J Gastroenterol1988;83: 1212-9.
34. HalpemSR, Sellars WA, JolmsonRB, AndersonDW, Saperstein S, Reisch JS. Development of childhood allergy in infants fed breast, soy, or cow milk. J AllergyClinlmmunol1973;51: 139-51.