Os formidáveis atributos dos Oligossacarídeos do Leite Humano (Human milk oligosaccharides – HMOs)
Prof. Dr. Ulysses Fagundes Neto
Os primeiros 1000 dias de vida, desde a concepção até cerca dos 2 anos de idade, representam um período crítico do crescimento e do desenvolvimento da criança, que constituem as bases futuras da saúde e bem-estar. Está amplamente reconhecido que a nutrição durante a primeira etapa da vida pode apresentar grande influência sobre o crescimento, a saúde imediata e a longo prazo. Neste aspecto, o aleitamento materno e a intervenção nutricional durante esse período crítico representam um auxílio fundamental para evitar o risco de enfermidades infecciosas, tanto na infância como nas etapas posteriores da vida (Figura 1).
A composição do leite humano encontra-se em constante modificação. Nos primeiros dias do aleitamento, as glãndulas mamárias produzem o colostro, um primeiro leite muito rico em nutrientes. A partir do quarto dia, ele se transforma em leite de transição, e, somente no décimo dia, as glândulas mamárias passam a produzir o leite maduro. Entretanto, esse leite também se modifica de forma permanente ao longo do crescimento do lactente (Figura 2).
O leite humano representa o padrão ouro da nutrição do lactente e lhe confere enorme proteção neste período da vida. Os lactentes amamentados de forma exclusiva até os 6 meses apresentam menor incidência de infecções gastrointestinais, do trato respiratório superior e inferior, bem como menor risco de desenvolver enfermidades alérgicas.
O leite humano é a principal referência para a nutrição do lactente. Além dos componentes nutricionais, o leite humano contém inúmeros compostos bioativos, tais como, os oligossacarídeos veiculados pelo leite (HMOs), proteínas, lipídeos, ácidos graxos poli-insaturados de cadeia longa, micro RNA, leptina, insulina e fatores de crescimento similares a insulina (IGF), assim como bactérias benéficas e células imunológicas. Todos esses fatores desempenham um papel fundamental, posto que favorecem o desenvolvimento de uma microbiota intestinal e um sistema imunológico, sadios e equilibrados (Figura 3).
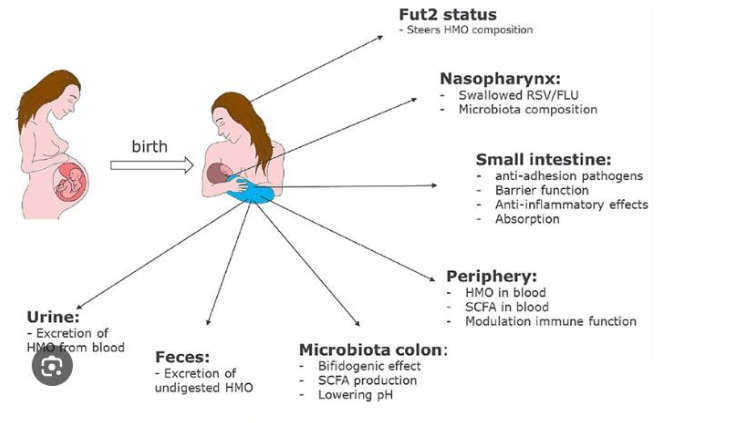
Os HMOs são componentes bioativos que dão suporte ao desenvolvimento da microbiota e ao sistema imunológico do lactente. O primeiro ano de vida é uma fase crítica durante a qual são estabelecidas as bases estruturais do desenvolvimento da criança. Para o lactente, em particular, este período representa uma etapa de elevada vulnerabilidade, mas, por outro lado, pode ser também importante janela de oportunidade, para moldar seu sistema imunológico à medida que avança na idade. O trato digestivo, a microbiota intestinal e o sistema imunológico encontram-se estreitamente interrelacionados. A microbiota intestinal promove o desenvolvimento e molda o sistema imunológico inato, e o sistema imunológico juntamente com a microbiota ativam o desenvolvimento do trato digestivo (Figura 4).
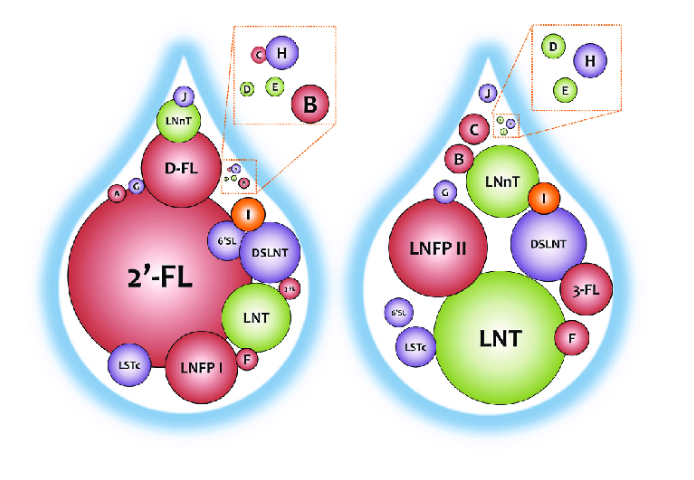
O leite humano é particularmente rico em carboidratos complexos, predominantemente não digeríveis, os assim chamados HMOs. A concentração de HMOs no leite humano alcança valores de 100 a 1000 vezes maiores do que no leite de qualquer animal. Os HMOs representam a terceira fonte de componentes sólidos do leite humano, apenas abaixo da lactose e dos lipídeos, tendo sido identificadas mais de 200 estruturas únicas de HMOs. Dentre os HMOs, a 2’FL (2’-Fucosillactose) e o LNnT (lacto-N-neotetrasosal), representam mais de 30% dos HMOs (Figura 5).
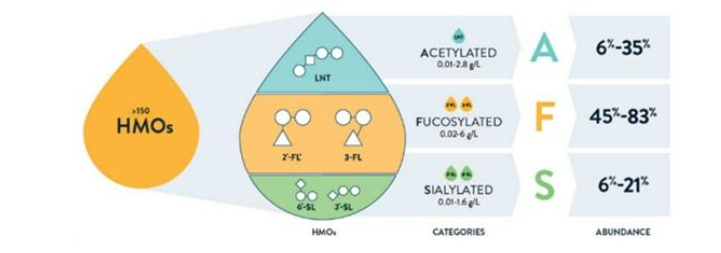
Os HMOs representam até 20g/l entre os componentes sólidos primários do leite humano e se constituem em um exemplo de pré-bióticos naturais. Os HMOs compreendem um grupo estruturalmente diversificado de moléculas que, por seu tamanho, se dividem em HMOs de cadeia curta e HMOs de cadeia longa. Os HMOs apresentam inúmeras funções, e, atualmente, sabe-se que existem mais de 1000 estruturas diferentes, das quais aproximadamente 200, têm sido identificadas nas amostras do leite humano, por meio da cromatografia e espectrometria de massas. Os perfis dos HMOs são nitidamente influenciados pela predisposição genética materna e podem se estratificar em 4 grupos de leite diferentes, dos quais 3 são os tipos principais, a saber:
- Pequenos:
trissacarídeos como a 2’-fucosilactose (FL), 3-FL, 3’-sialilactose (SL) ou 6’-SL;
- B) Grandes:
1- Ácidos (sialilados) ou neutros (não sialilados)
2- Fucosilados ou não fucosilados.
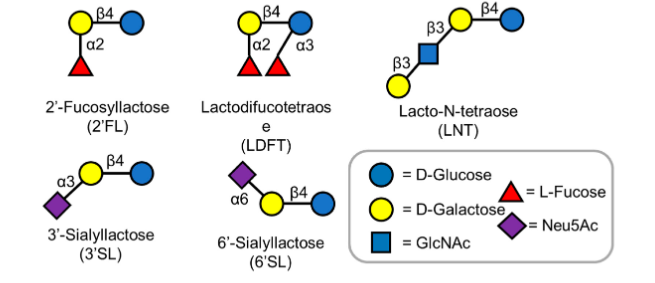
Levando-se em consideração seus elementos constituintes, os HMOs podem ser definidos em 3 categorias principais, a saber (Figura 6):
1) HMOs neutros ou fucosilados que contêm fucose na posição terminal (2’-FL),
2) HMOs neutros com N ou não fucozilados, que contém N-acetilglucosamina no extremo terminal, como por exemplo lacto-N-tetraose (LNnT)
3) HMOs ácidos ou sialilados, que contém ácido siálico no extremo terminal, por exemplo 2’-SL.
A maioria dos HMOs não sofre digestão no intestino delgado e avança em direção ao intestino grosso, onde são metabolizados e servem como nutrientes para as bactérias intestinais comensais. Este processo dá lugar à produção de componentes benéficos que desempenham importante papel na nutrição e no desenvolvimento da microbiota intestinal do lactente, no funcionamento da barreira intestinal, no cérebro e no sistema imunológico.
Os perfis de HMOs, quanto a diversidade estrutural e abundância, são significativamente influenciados pela predisposição genética materna, e, podem se estratificar em 4 grupos de leites diferentes, a saber (Figura 7):
- Grupo 1: contém todos os tipos de fucosiloligossacarídeos, com ligações α1,2, α1,3 e α1,4
- Grupo 2: desprovido de α1,2 fucosiloligossacarídeo devido a ausência da expressão do gene secretor
- Grupo 3: identificado pela ausência do α1,4 fucosiloligossacarídeo devido a inatividade do gene de Lewis e
- Grupo 4: contém somente o α1,3 fucosiloligossacarídeo devido a expressão do fucosiloligossacarídeo independente de Lewis.
Os HMOs de uma forma geral não têm valor nutritivo, porém, desempenham relevante papel no apoio ao sistema imunológico, que a seguir, será explicitado (Figura 8):
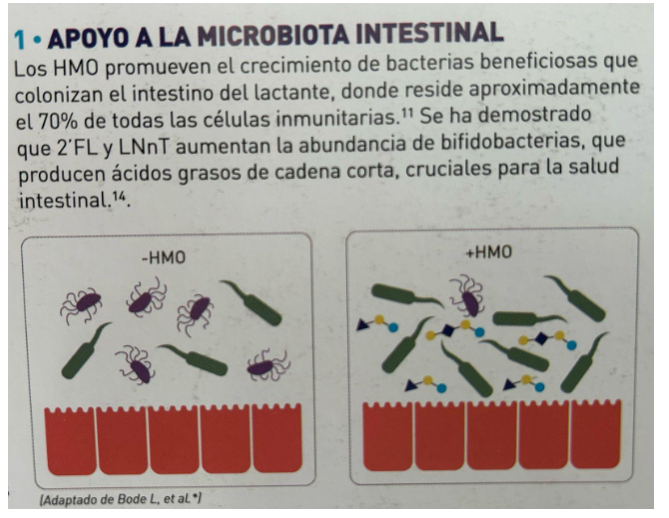
- Apoio à microbiota intestinal
Os HMOs promovem o crescimento de bactérias benéficas que colonizam o intestino do lactente, local que abriga aproximadamente 70% de todas as células imunológicas. Tem sido demonstrado que a 2’FL e o LNnT aumentam a quantidade de bifidobactérias, as quais produzem ácidos graxos de cadeia curta, cruciais para a saúde intestinal.
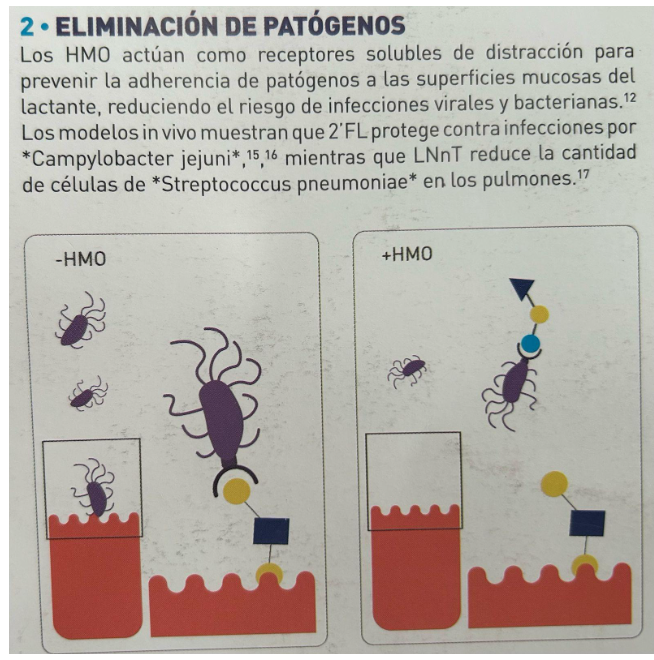
2. Eliminação de Patógenos
Os HMOs funcionam como receptores solúveis que evitam a adesão de enteropatógenos às superfícies mucosas do lactente, reduzindo o risco de infecções virais e bacterianas. Modelos in vivo demonstraram que a 2’FL protege contra infecções por Campylobacter jejuni, enquanto o LNnT reduz.
3. Apoio à função da barreira intestinal
Os HMOs fortalecem a barreira intestinal ao promover a proliferação e maturação das células intestinais. Os HMOs modulam a expressão dos seus genes, em particular a expressão das proteínas de ligação estreita e componentes do glicocálice, fortalecendo a função da barreira intestinal.
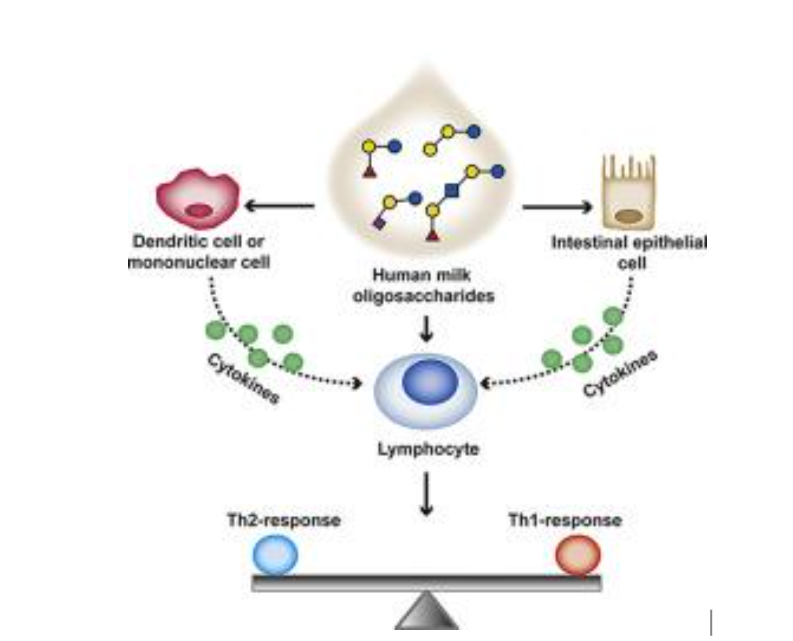
4. Maturação do sistema imunológico
Os HMOs atuam em nível sistêmico para modular as interações entre as células imunológicas e ajudam na manutenção de uma resposta inflamatória equilibrada. Os HMOs como a 2’FL possuem efeitos anti-inflamatórios vinculados à atividade Th21 (Figura 9).
Está cientificamente comprovado que as menores taxas de infecção e alergia estão diretamente relacionadas com os efeitos imunomoduladores e modificadores da microbiota, devido aos componentes do leite materno, em especial à lactose e aos oligossacarídeos (Figuras 10, 11 e 12).
Figura 10- Minha filha Walkyria ainda recém-nascida que foi amamentada de forma exclusiva até o sexto mês de vida por sua mãe Fábia.
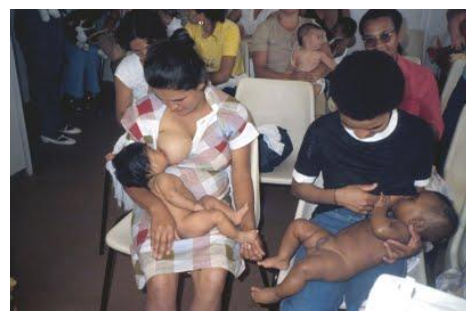
Mães da favela da Cidade Leonor (São Paulo) amamentando seus filhos dentro do Programa de Promoção ao Aleitamento Natural introduzido nesta comunidade no início da década de 1990, sob minha coordenação.
Figura 12- Mulher índia, nativa do Parque Indígena do Xingú amamentando sua filha, neste momento já com mais de 1 ano de idade, prática universal nesta comunidade indígena, onde tive o prazer de trabalhar ao longo de 30 anos da minha carreira médica.
Referências Bibliográficas
- Valdes e cols. – BMJ 2018;261:2179
- Bailey e cols. – Gut Microbes 2022;1:96
- Sampson HA e cols. – J Allergy Clin Immunol 2018;141:11-19
- Mitre E e cols. – JAMA Pediatric 2018;172:315